Szmaciak galezisty – na pomoc w walce z alergia, HIV i grzybica wieloukladowa

Szmaciak gałęzisty / Sparassis crispa / Siedzuń sosnowy/ Cauliflower mushroom – Prawie do konca 2014 roku byl na liscie grzybow chronionych. Na dzien dzisiejszy mimo ze jest nadal rzadkim okazem mozna go juz zbierac legalnie.
Sklad: Sesquiterpenoid, sesquiterpenoid, (3R(*), 3aS(*), 4S(*), 8aR(*))-3-(1′-hydroxy-1′-methylethyl)-5,8a-dimethyldecahydroazulen-4-ol , sparassol(methyl-2-hydroxy-4-methoxy-6-methylbenzoate), methyl orsellinate, β-1,3-glucan (β-glucan)(pow.40%), p-hydroxybenzoic acid, ergosterol, hanabiratakelide A , B i C, ubiquinone-9, glucosyl ceramide, 3-octanone, DL-3-octanol, i 1-octen-3-ol, methyl-2,4-dihydroxy-6-methylbenzoate, methyl-dihydroxy-methoxy-methylbenzoate, xanthoangelol , 4-hydroxyderricin,
- wykazuje wlasciwosci antynowotworowe wzgledem miesaka (nowotwor tkanki lacznej) (badanie na myszach)
- hamuje acetylcholinesterase (AChE)(enzym ktory powoduje paralize w przypadku miedzyinnymi choroby typu miastenia, borelioza) i glutathione S-transferase (GST)
- polisacharydy ze Szmaciaka wykazuja dzialanie neuroprotekcyjne wzgledem glutaminianu czyniac z niego potencjalny lek w przypadku chorob neurodegeneracyjnych typu Parkinson, Alzheimer, Neuroborelioza, Autyzm.
- Obniza cholesterol
- Posiada dzialanie antyoksydacyjne(takze b.przydatne w przypadku kazdej infekcji i kazdej choroby neurodegeneracyjnej)
- zwieksza poziomy cytokin prozapalnych(limfocyty th1) GM-CSF, IFN-γ, IL-6, IL-8 TNF alfa, IL-12 i leukocyty
- wykazuje wlasciwosci nawadniajace skore czlowieka(udowodnione w badaniu typu 'podwojna slepa proba’ czyli mozna uznac to za pewnik)
- zwieksza szybkosc gojenia sie ran u cukrzykow
- Napar ze szmaciaka zmniejsza wyrzut histaminy oraz wapnia z komorek tucznych jak i rowniez immunoglobuliny IgE. U alergikow z kolei zmniejsza wytwarzanie TNF-alfa, IL-6, IL-1beta (poprzez hamowanie NFkappaB)
- Obniza cisnieni krwi, chroni przed zawalem, przedluza zycie, zwieksza przeplyw krwi. Wniosek z badania – lagodzi zaburzenia czynnosci srodblonka naczyn mozgowych(poprzez fosforylacje eNOS zalezna od szlaku sygnalowego Akt – Akt to regulator metabolizmu i progresji nowotworow), zwieksza poziom tlenku azotu w korze mozgowej – badanie na szczurach.
- 1,3 beta-D-glukany pobudzaja wrodzony uklad immunologiczny organizmu (poprzez wplyw na gen TLR4 i NFkappaB)
- hanabiratakelide A , B i C i ubiquinone-9 – zwiazki zawarte w Szmaciaku hamuja nadmiernie pobudzony tlenek azotu(przez makrofagi) oraz progstaglandyne zapalna E2 (PGE2) wykazujac tym samym dzialanie przeciwzapalne. Dodatkowo hannabiratakolidy jak i ergosterol dzialaja przeciwnowotworowo wzgledem raka jelita grubego.
- Wykazuje dzialanie antyrakowe w stosunku do czerniaka skory (zapobiega przerzutom = metastazie oraz angiogenezie = rozbudowie naczyn krwionosnych zywiacych komorki rakowe
- Beta glukany ze Szmaciaka aktywuja receptor Dectin-1 – wspominalem juz o nim wczesniej w artykule o CARD9 i Dectin-1 (w skrocie – wiele typow grzybow jelitowych ala Candida jest niewidzialnych dla systemu odpornosciowego gdyz nie sa wykrywane przez receptor Dectin-1 lub tez poprostu go blokuja. Receptor ten wysyla0 sygnal do CARD9 —-> nastepnie do komorek dendrycznych —->a te z kolei aktywuja ukl.odpornosciowy do walki z grzybica w roznych rejonach organizmu)
- Hamuje infekcje gronkowcem zlocistym(jego namnazanie sie)
- Hamuje synteze melaniny(naturalnie nie stosuje sie tego grzyba miesiacami stad nie przejmowalbym sie ta wlasciwoscia)
- Hamuje enzym odwrotnej transkryptazy (namnazanie sie) wirusa HIV (w 70.3%) – jako ciekawostka grzyb R. paludosa(Golabek blotny) hamuje go w 97%!!!
- Zwieksza cytotoksycznosc komorek NK (natural killers) jednak nie zwieksza ich liczebnosc
- Sparassol(substancja ze Szmaciaka) jest antybiotykiem, ktory skutecznie zwalcza laseczke sienna(Bacillus subtillis – bakteria gram ujemna), zarowno Sparassol jak i inne 2 substancje ( methyl-2,4-dihydroxy-6-methylbenzoate i methyl-dihydroxy-methoxy-methylbenzoate ) posiadaja dzialanie przeciwgrzybiczne
- xanthoangelol i 4-hydroxyderricin zwalczaja gronkowca zlocistego
- Obniza cukier we krwi jak i ilosc wytwarzanej insuliny jak i rowniez zwieksza wytwarzanie adiponektyny( adiponektyna umozliwia przemianę glukozy i kwasów tłuszczowych w wątrobie i mięśniach, pośrednio wpływając na wrażliwość na insulinę. Wykazuje w związku z tym działanie przeciwzapalne, przeciwmiażdżycowe i zwiększające insulinowrażliwość).
Dawkowanie:
Świeżo zebrany owocnik wysuszyc w temp. 40 stopni i spozywac (najlepiej w kapsulkach dojelitowych) – 3x 1-2gramy.
Odwar: 20 gram suszonego grzyba gotowac w 500ml wody przez 40 minut na niskim ogniu. Pic trzy razy dziennie.
Intrakt na alkoholu 70% 1:3. Świeży owocnik rozdrobnic , zalac ciepłym alkoholem o temp. 40 stopni. Podawac 3 razy dziennie po 5 ml.
Post wydał Ci się wartościowy?a może po prostu mnie lubisz ;)?podziel się nim na Facebooku i go udostępnij!
Polub tego bloga na FB, gdzie znajdziesz też dodatkowe newsy, których tutaj nie publikuje https://www.facebook.com/zdrowiebeztajemnic
Obserwuj mnie na instagramie www.instagram.com/premyslaw84
Głosuj i wybieraj kolejne tematy – prawa strona bloga – zakładka „Ankieta”
ncbi.nlm.nih.gov/pmc/articles/PMC3613060/
pl.wikipedia.org/wiki/Adiponektyna
ncbi.nlm.nih.gov/pubmed/12581496
ncbi.nlm.nih.gov/pubmed/19180796
ncbi.nlm.nih.gov/pubmed/15553707
ncbi.nlm.nih.gov/pubmed/16670126
ncbi.nlm.nih.gov/pubmed/17113195
ncbi.nlm.nih.gov/pubmed/17617705
ncbi.nlm.nih.gov/pubmed/18328447
ncbi.nlm.nih.gov/pubmed/18585672
ncbi.nlm.nih.gov/pubmed/18729738
ncbi.nlm.nih.gov/pubmed/19182386
ncbi.nlm.nih.gov/pubmed/20686231
en.wikipedia.org/wiki/TLR4
ncbi.nlm.nih.gov/pubmed/20699131
ncbi.nlm.nih.gov/pubmed/20699131
ncbi.nlm.nih.gov/pubmed/21076883
ncbi.nlm.nih.gov/pubmed/21116778
ncbi.nlm.nih.gov/pubmed/22577976
ncbi.nlm.nih.gov/pubmed/22614038
ncbi.nlm.nih.gov/pubmed/23748764
ncbi.nlm.nih.gov/pubmed/24018675
ncbi.nlm.nih.gov/pubmed/24266377
ncbi.nlm.nih.gov/pubmed/24657542
ncbi.nlm.nih.gov/pubmed/25071386
ncbi.nlm.nih.gov/pubmed/26756185
ncbi.nlm.nih.gov/pubmed/26756188
ncbi.nlm.nih.gov/pubmed/26821016
ncbi.nlm.nih.gov/pubmed/10919368
ncbi.nlm.nih.gov/pubmed/?term=sparassol
ncbi.nlm.nih.gov/pubmed/19129625
ncbi.nlm.nih.gov/pubmed/27481295
Wirus Epstein Barra – EBV- jakie schorzenia powoduje?jak go zwalczyc – cz.1
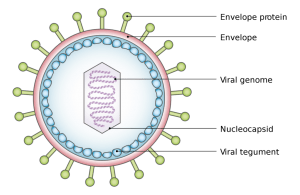
Komórki ukladu odpornosciowego zwane CD8+, sa typem komórek, które hamuja replikacje wirusów. Ich niedobór jest przyczyna wielu przewleklych chorób autoimmunologicznych w tym stwardnienia rozsianego, reumatoidalnego zapalenia stawów (RZS), tocznia ukladowego, zespolu Sjogrena, twardziny ukladowej, zapaleñ skórno-miesniowych, marskosci watroby, zapalenia dróg zólciowych, wrzodzejacego zapalenia jelita grubego, choroby Lesniowskiego Crohna, luszczycy, bielactwa, lysienia plackowatego, cukrzycy typu 1, choroby Gravesa-Basedowa, zapalenia tarczycy Hashimoto, miasteni, nefropati czy tez anemi zlosliwej. Niektórzy naukowcy twierdza, ze niedobór komórek CD8+ lezy u podstaw rozwoju przewleklych chorób autoimmunologicznych poprzez brak kontroli nad wirusem EBV. W momencie kiedy nie jest on kontrolowany przez uklad odpornosciwoy, moze siac spustoszenie. EBV zaraza limfocyty B powodujac ze zaczynaja(ich przeciwciala) atakowac Twoje wlasne tkanki. Wg. tej hipotezy schorzenia autoimmunologiczne przebiegaja mniej wiecej tak:
- Infekcja EBV i proliferacja (namnazanie/podzial) wynika z niedoboru komórek T CD8+. Nastepuje zwiekszona liczba przeciwcial przeciwko EBV(cos w rodzaju drugiej lini obronnej). EBV infekuje jakis konkretny organ oraz komórki B w tym organie. W tym momencie komórki B atakuja wlasne tkanki. Jedna z teorii glosi, ze wirusy i bakterie maja bialka podobne do naszych wlasnych bialek, przez co blednie uklad odpornosciowy atakuje tez i wlasne bialka. Takie 'zamieszanie’ nazywane jest mimikra molekularna”. Komórki typu B nastepnie namnazaja sie w zainfekowanym organie, komórki T sa przyciagane do narzadu i niszcza nasze wlasne tkanki.
- Z wiekiem ilosc komórek CD8+ maleje, co jest jednym z powodów dlaczego autoagresja ukladu odpornosciowego wzrasta. Estrogen równiez obniza poziomy CD8+, co wyjasnia wiekszy procent chorób z grupy autoagresji u kobiet(np.chociazby autoagresja tarczycy). Promienie sloneczne/witamina D jest bardzo wazna w produkcji CD8+, co potwierdza sie w krajach mniej slonecznych i ze zwiekszona iloscia chorób autoimmunologicznych. Nalezy nadmienic, ze przewlekly stres moze aktywowac EBV poprzez obnizenie odpowiedzi immunologicznej Th1
W przypadku infekcji EBV spada poziom pregnenolonu a z nim i reszty hormonów. Hormon ten, jest neurosteroidem. Poprzez dzialanie majace na celu ukierunkowanie pregnenolonu do produkcji kortyzolu obniza jego poziom przez co takie skutki uboczne jak niski kortyzol nie pozwalajacy z rana wstac z lózka i powodujac przemeczenie za dnia. Kiedy infekcja wirusowa jest aktywna, pobudza ona szlak mewalonianu(kwas przyczyniajacy sie do biosyntezy cholesterolu, który z kolei niezbedny jest do wytwarzania hormonów). W odpowiedzi na ta aktywnosc organizm wytwarza interferon który tlumi szlak mewalonianu a to hamuje wirusa. Podczas tego procesu jest jednak zmniejszana synteza prognenolonu oraz koenzymu Q10. Spekuluje sie, ze wirusem który hamuje w/w sciezke jest EBV – wirus Epstein-Barra. Wzmozone wytwarzanie interferonu jest bardzo pomocne w krótkim okresie czasu, niestety na dluzsza mete w organizmie zaczynaja sie braki koenzymu Q10 i kluczowych hormonów co ma np.miejsce w syndromie przewleklego zmeczenia. Takze trzeba zwrócic uwage na to, ze osoby które beda mialy przez dluzszy czas podwyzszone ramie ukladu odpornosciowego – Th1 – beda mialy problemy z gospodarka hormonalna i wynikajace z nich schorzenia. Zatem wszystko co zwieksza limfocyty th1(zwlaszcza interferon) – bedzie hamowac EBV.
Co jeszcze powoduje EBV + dodatkowe informacje?
– EBV moze powodowac chloniaka Burkitta oraz nowotowry ukladu chlonnego, nosogardla, zoladka, glowy, szyi, sutka.
– pierwsza linia obrony to komórki NK – a nastepnie CD3+CD8+ (limfocyty T cytotoksyczne).
– EBV posiada w sobie bialko BCRF1, które zwieksza cytokine przeciwzapalna IL-10 oraz zmniejsza interferony gamma i IL-12
– Zaburza wytwarzanie serotoniny oraz miesza w genach metylacyjnych
– moze powodowac droznosc bariery krew-mózg
– Mononukleoza to tylko 50% aktywnej postaci EBV(tj.50% przypadków)
– EBV w badaniach dziala negatywnie na nerki(zwieksza immunoglobuline IgA, pogorszenie ich funkcjonowania jak i niewydolnosc, bialkomocz czy krwiomocz takze sa notowane)
– typowe symptomy EBV – goraczka, ból gardla, zóltaczka lub zapalenie watroby, wysypka po antybiotyku, niedokrwistosc, podwyzszenie prób watrobowych, podwyzszone wartosci azotu mocznika w surowicy czy tez kreatyniny.
Co moze aktywowac EBV?
– stres psychiczny
– kortyzol/glikortykosteroidy
– brak snu
Suplementy zwiekszajace ilosc limfocytów T CD8+
– Schisandra Chinesis (Cytryniec) – powstrzymuje spadek CD8+
– NAC
– Ashwagandha
– oporna skrobia(niedojrzale banany, ugotowana i schlodzona owsianka)/HMB – w badaniach wykazano ze zuzyte komórki CD8+ w chronicznej infekcji wirusowej odnowily sie! Ponadto zwieksza ilosc i pamiec komórek CD8+
– Astragalus
– Andrographis – wzrost CD4+ o 40-61% a CD8+ o 23-31%
– Gynostemma
Inne:
– Masaz leczniczy
– Aldosteron(hormon)
– enzym ADA
W badaniach wykazano zmniejszona ilosc komórek natural killers NK i uposledzenie ich cytotoksycznosci w krwi obwodowej u pacjentów z chorobami autoimmunologicznymi takimi jak stwardnienie rozsiane, reumatoidalne zapalenie stawów, toczeñ rumieniowaty, choroba Sjogrena, cukrzyca typu 1, autoimmunologiczne choroby tarzycy, luszczyca, mlodzieñcze idiopatyczne zapalenie stawów itp etc. Komórki NK zwalczaja wirusy, uwalniaja interferon gamma i moga tlumic w pewnym sensie uklad odpornosciowy.
Badania wykazaly nagromadzenie komórek NK w zaatakowanej tkance pacjentów z chorobami autoimmunologicznymi. Komórki NK zostaly znalezione w tkankach osób z cukrzyca typu 1, mieszkach wlosowych osób z lysieniem plackowatym, tkankach miesniowych u dzieci z mlodzieñczym zapaleniem skórno-miesniowym, w zmianach chorobowych u osób z luszczyca czy tez w mazi stawowej u osób z zapaleniem stawów. Komórki NK moga byc bezposrednio zaangazowane w tych chorobach poprzez ataki na tkanki wlasne organizmu, lub poprzez stymulacje komórek dendrycznych, makrofagów lub limfocytów T, powodujac w ten sposób stan zapalny. Takze komórki NK odgrywaja dwuznaczna role – chronia przed autoagresja lub tez ja wywoluja.
Suplementy (i nie tylko), które hamuja limfocyty th1 jednak ochronia jednoczesnie przed aktywacja EBV:
– Magnez
– Resweratrol
– Olej sezamowy
– Ekstrakt z liscia oliwnego(oleuropeina)
– Lukrecja
– Kwas ursolowy
– Kurkumina,
– EGCG(zielona herbata)
– Olej z czarnuszki
– Sloñce/promienie UVB
– Witamina d3
– oleje rybne/DHA+EPA
– Witamina A(retinol)
– Interwaly(cwiczenia o wysokiej intensywnosci)/L-arginina (cokolwiek co podwyzszy tlenek azotu-NO)
– Andrografis
– Laktoferyna
– Aspiryna
– Artemezina
– Boswelia
– Tarczyca Bajkalska
– Cytrusy
– Kwercytyna
– Ostropest plamisty
– kwas oleanolowy
– Kwas korozolowy
– Honokiol(Mangolia) – niweluje takze skutki uboczne aktywacji EBV
– Inozytol – zwieksza ilosc wewnatrzkomórkowego wapnia i zmniejsza zewnatrzkomórkowego.
– Pregnenolon (hamuje szlak mewalonianu)
– Koenzym Q10 – niezbedne przy aktywnym EBV
– i pare innych (z czasem bede dopisywal)
Post wydał Ci się wartościowy?a może po prostu mnie lubisz ;)?podziel się nim na Facebooku i go udostępnij!
Polub tego bloga na FB, gdzie znajdziesz też dodatkowe newsy, których tutaj nie publikuje https://www.facebook.com/zdrowiebeztajemnic
Obserwuj mnie na instagramie www.instagram.com/premyslaw84
Głosuj i wybieraj kolejne tematy – prawa strona bloga – zakładka „Ankieta”
Bogna Roszkowiak, Zofi a I. Niemir
Pracownia Nefrologii Molekularnej, Katedra i Klinika Nefrologii, Transplantologii i Chorób Wewnetrznych Akademii
Medycznej im. K. Marcinkowskiego w Poznaniu „Udzial wirusa Epsteina-Barr w patogenezie tocznia rumieniowatego ukladowego i chorób nerek”
hindawi.com/journals/ad/2012/189096/
hindawi.com/journals/ad/2012/189096/
ncbi.nlm.nih.gov/pmc/articles/PMC3422678/
ncbi.nlm.nih.gov/pubmed/18625298
ncbi.nlm.nih.gov/pubmed/11719627
ncbi.nlm.nih.gov/pubmed/18625298
ncbi.nlm.nih.gov/pubmed/21289059
ncbi.nlm.nih.gov/pubmed/16055563
ncbi.nlm.nih.gov/pubmed/20826008
ncbi.nlm.nih.gov/pubmed/2169064
ncbi.nlm.nih.gov/pubmed/11719627
ncbi.nlm.nih.gov/pubmed/10887139
ncbi.nlm.nih.gov/pmc/articles/PMC3250620/
nasa.gov/mission_pages/station/research/experiments/47.html
ncbi.nlm.nih.gov/pubmed/22735892
ncbi.nlm.nih.gov/pmc/articles/PMC4196144/
ncbi.nlm.nih.gov/pubmed/22077226
examine.com/supplements/Andrographis+paniculata/
ncbi.nlm.nih.gov/pubmed/24832985
egh.net.cn/EN/abstract/abstract2207.shtml
ncbi.nlm.nih.gov/pubmed/16603328
bloodjournal.org/content/90/5/2089?sso-checked=true
ncbi.nlm.nih.gov/pubmed/8707483
jimmunol.org/content/184/1/191.full
ncbi.nlm.nih.gov/pubmed/21865054?dopt=Abstract
ncbi.nlm.nih.gov/pmc/articles/PMC3979027/
ncbi.nlm.nih.gov/pmc/articles/PMC2999796/table/tbl1/
ncbi.nlm.nih.gov/pmc/articles/PMC2999796/
ncbi.nlm.nih.gov/pubmed/7545094
neurology.org/content/76/16/1410.abstract
ncbi.nlm.nih.gov/pubmed/15036655
ncbi.nlm.nih.gov/pubmed/6850568
ncbi.nlm.nih.gov/pubmed/8874215
ncbi.nlm.nih.gov/pubmed/10887139
ncbi.nlm.nih.gov/pubmed/12490409
ncbi.nlm.nih.gov/pubmed/23846901
ncbi.nlm.nih.gov/pubmed/11870879
ncbi.nlm.nih.gov/pubmed/11884218
ncbi.nlm.nih.gov/pubmed/23180656
ncbi.nlm.nih.gov/pubmed/23089554
ncbi.nlm.nih.gov/pubmed/18981566
ncbi.nlm.nih.gov/pubmed/22433582
ncbi.nlm.nih.gov/pubmed/18699744
ncbi.nlm.nih.gov/pubmed/16946522
ncbi.nlm.nih.gov/pubmed/1318792
ncbi.nlm.nih.gov/pubmed/6850568
ncbi.nlm.nih.gov/pubmed/10395183
researchgate.net/publication/228356012_Cancer_Preventive_Agents._7._Antitumor-Promoting_Effects_of_Seven_Active_Flavonolignans_from_Milk_Thistle_(Silybum_marianum.)_on_Epstein-Barr_Virus_Activation/file/d912f511ef9975ff44.pdf
ncbi.nlm.nih.gov/pubmed/20948499
ncbi.nlm.nih.gov/pubmed/12162952
ncbi.nlm.nih.gov/pmc/articles/PMC3002804/
ncbi.nlm.nih.gov/pubmed/18423902
ncbi.nlm.nih.gov/pubmed/3802058
ncbi.nlm.nih.gov/pubmed/3006912
researchgate.net/publication/8901809_Triterpene_acids_from_the_leaves_of_Perilla_frutescens_and_their_anti-inflammatory_and_antitumor-promoting_effects
ncbi.nlm.nih.gov/pubmed/1659613
jimmunol.org/content/179/2/753.long
ncbi.nlm.nih.gov/pubmed/2555195
ncbi.nlm.nih.gov/pubmed/15856040
Żółtlica drobnokwiatowa – h.pylori killer, neuroprotekcja, cukrzyca i nowotwory

Żółtlica drobnokwiatowa – Galinsoga parviflora
Ziele żółtlicy jest źródłem witaminy C, potasu, żelaza, krzemu, kwasu kawowego i chlorogenowego, bioflawonoidów, przeciwzakrzepowych kumarynowców i poliacetylenów Z)-3-hexen-1-ol (21.7%), beta-caryophyllene (12.4%), and 6-demethoxy-ageratochrome (14%), triakontanol, fitol, stigmasterol, 7-hydroksy-p-sitosterolu, 7-hydroxystigmasterol, beta-sitosterol, 3-O-p-D-glukozyd kwasu 3,4-dimetoksycynamonowego, kwasu protokatechowego, kwasu fumarowego, uracylu,triacontanolu, phytolu, 3,4-dimethoxycinnamic acid, protocatechuic acid, fumaric acid, i uracil(ciężko było z tłumaczeniem więc pozostawiłem częściowo angielskie nazwy).
– Galinsoga parviflora i Galinsoga quadriradiata chronią przed wolnymi rodnikami i promieniami UV(napary)
– Żółtlica drobnokwiatowa wykazuje działanie zbijające wysokie poziomy cukru we krwi oraz regulujące wysokie nadciśnienie
– Jest blokerem konwertazy angiotensyny ACE (stosuje je się w przypadku niewydolności lub niedokrwienia serca, cukrzycowej chorobie nerek, nefropatii nadciśnieniowej, cukrzycy i w przypadku zespołu metabolicznego).
– beta-caryophyllene – substancja zawarta w żółtlicy ma działanie przeciwbólowe(działa synergicznie pod tym względem z kwasem DHA). Zwiększa on także poziomy estradiolu i testosteronu.
– W/w związek ma działanie cytoprotekcyjne (komórkoochronne) i przeciwzapalne w układzie pokarmowym. Hamuje on uszkodzenia śluzówki wywołane przez etanol i 0.6 N HCL.
– w/w związek pobudza receptory kanabinoidowe CB2 (ten same receptor pobudza narkotyk miękki marichuana – z tymże pobudza dodatkowo receptor CB1 przez co użytkownik doświadcza efektu 'haju’ 😉 – beta caryohyllen tego nie robi). Dzięki pobudzeniu CB2 obniża stany zapalne,zmniejsza ból, leczy miażdżycę i osteoporozę.
– beta-caryophellene hamuje metastazę(przeżuty nowotworowe) poprzez wpływ na ścieżkę sygnałową PI3K/AKT/mTOR/S6K1
– w/w związek hamuje zapalny czynnik transkrypcyjny NF-kappaB zwłaszcza w komórkach rakowych, CXCL1/KC, LTB4, cytokinę zapalną IL-12 oraz produkcję tlenku azotu
– Olejek z żółtlicy wykazuje właściwości bakteriobójcze przeciwko Staphylococcus aureus(gronkowiec złocisty) i Bacillus cereus.
– Triakontanol – związek z żółtlicy ma działanie hamujące tworzenie stanu zapalnego przez niektóre z komórki układu odpornościowego
– Wyciąg alkoholowy z Żółtlicy zmniejsza poziomy prób wątrobowych o 87%(ALAT – enzym aminotrasferazy) u szczórów z marskością wątroby oraz zmniejsza stężenie glukozy we krwi u szczurów z cukrzycom.
– Nalewką alkoholowa z Żółtlicy wykazuje aktywność przeciwbakteryjną przeciwko Bacillus subtilis, Pseudomonas aeruginosa, Escherichia coli, Aspergillus niger i Candida albicans
– Żółtlica wykazuje właściwości antyoksydacyjne
– Bakteria Helicobacter pylori(o której więcej pisałem już tutaj) produkuje enzym zwany ureazą, który rozkłada w żołądku mocznik na amoniak. Amoniak przekształca się w zasadę, która neutralizuje kwas solny ochraniając tym samym pylori. Bez ureazy H.pylori jest częściowo bezbronna i łatwiej ją pokonać. Żółtlicy zawiera w sobie 2 substancje – Galinsosides A i Galinsosides B – galinosides A ma właściwości blokujące ureazę tym samym pozbawiając pylori części z jej właściwości ochronnych.
– Związek zawarty w Żółtlicy – triakontanol – także wykazuje właściwości przeciwzapalne(podejrzewa się, że hamuje peroksydazę lipidów)
– Kwas protokatechowy zawarty w żóltlicy ma właściwości hepaprotekcyjne – w badaniu na szczurach, które były poddane endotoksynie, obniża podniesione próby wątrobowe ALT i AST) (hamuje iNOS – syntaze tlenku azotu który jest pobudzany przez interferon gamma)
– Kwas protokatechowy wykazuje działanie antyoksydacyjne, neuroprotekcyjne oraz ochrania komórki i ich mitochondria przed spadkiem glutationu(GSH), nie dopuszcza do aktywacji kaspazy 3 (blokuje ona receptor witaminy D3 VDR przez co jest problem z wykorzystaniem tej witaminy przez organizm), oraz nie dopuszcza do obniżenia Bcl-2(białko zapobiegające apoptozie/śmierci komórki). Jedno z badań rekomenduje ten kwas jako potencjalny środek zapobiegawczy w chorobie Parkinsona.
– w/w kwas obniża zapalną cytokinę IL-1, TNF alfa oraz prostaglandyne E2(PGE2) w mózgu (bardzo przydatne przy SM,Alzheimerze czy Parkinsonie).
– w/w kwas ma działanie chemoprotekcyjne gdyż w badaniach in vitro wykazuje działanie antykancerogenne oraz wykazuje działanie proapoptyczne(powoduje śmierć komórek rakowych) jak i antyproliferacyjne(nie dopuszcza do namnożenia się komórek rakowych).
– w/w kwas wykazuje działanie cytoprotekcyjne, wzmacniając błonę śluzową żołądka. Może on również posiadać właściwości przeciwwrzodowe.
– W badaniu na szczurach w/w kwas wykazał właściwości zwiększające peroksydazę glutationową, katalazę oraz dysmutazę ponadtlenkową (SOD)(więcej o SOD pisałem już tutaj)
– w/w kwas w badaniach wykazuje antyfibrynogenne właściwości. TGF-beta1 oraz czynnik wzrostu CTGF są bezpośrednio związane ze zwłóknieniem wątroby. Kwas protokatechowy obniża poziomy wątrobowego TGF-beta1 oraz CTGF, poziomy kolagenu typu 1 i typu 3 niedopuszczając do zwłóknienia.
– Kwas protokatechowy wykazuje właściwości wirusobójcze względem wirusowego zapalenia wątroby typu B
– w/w kwas hamuje napływ monocytów(tzn.ich przyleganie) do śródbłonka aorty (napływ spowodowany był cytokiną zapalną TNF alfa). Dzieje się to dzięki hamowaniu naczyniowym cząsteczki adhezyjnej VCAM-1 oraz cząsteczki międzykomórkowej ICAM-1(pobudzane przez bakterie Bartonella). Dzięki temu posiada właściwości przeciwmiażdzycowe.
– w/w kwas zwiększa ilość neuronów oraz ich przeżycie jak i średnią długość nerwu w korze mózgu (u szczurów)
– w/w kwas posiada właściwości neuroprotekcyjne względem glutaminianu i jego neurotoksycznego działania.
– w/w kwas posiada właściwości chelatujące w organizmie z wapnia i żelaza (także trzeba to uwzględnić w diecie/suplementacji lub specjalnie włączyć to zioło w przypadku zbyt wysokiego poziomu żelaza lub wapnia)
– w/w kwas obniża poziomy cytokin IL-6 i IL-8(aktywowane przez międzyinnymi bakterie Bartonella) oraz aktywuje PPAR-gamma(receptory jądrowe które przyczyniają się do tycia, PPAR alfa np. sprzyjają gubieniu tkanki tłuszczowej)
– w/w kwas wykazuje właściwości antybakteryjne względem Helicobacter pylori oraz Streptococcus faecalis, Candida albicans, Microsporum audouinii i Staphylococcus aureus(wykazano zahamowanie wzrostu o 80%)
– w/w kwas stymuluje ścieżkę sygnałową insuliny poprzez zwiększenie GLUT4 oraz wychwyt glukozy (zmniejszenie insulinooporności jest kluczowe w przypadku syndromu metabolicznego i cukrzycy typu 2)
– w/w kwas pobudza komórki Schwanna (ich migrację i zdolności do protekcji uszkodzonej mieliny aksonu nerwu) poprzez szlaki MAPK (ERK1/2, JNK,p38, metaloproteinazy 2 i 9) – wcześniej pisałem o takich zdolnościach w przypadku suplementu diety PQQ(w tym artykule)
– Kwas protokatechowy(PCA) zmniejsza żywnotność komórek, zwiększa przeciek dehydrogenazy mleczanowej, zwiększa fragmentację DNA oraz zmniejsza przepuszczalność/trwałość błony śluzowej komórek nowotworowych raka piersi MCF7, komórek A459 raka płuc, komórek raka wątroby HepG2 i HeLA, oraz komórek nowotoworowych LNCaP raka prostaty. Zmniejsza także cytokiny zapalne IL-6 i IL8 w komórkach rakowych oraz czynnik wzrostu śródbłonka w komórkach nowotworowych(VEGF – bakteria bartonelli np. go zwiększa). W badaniu zasugerowano, że ten związek ma spory potencjał do blokowania metastazy(przeżutów) oraz apoptyzy(śmierci) komórek rakowych
– w/w kwas zwiększa wytwarzanie insuliny oraz obniża poziomy glukozy we krwi (u myszy z cukrzycą)
– w/w kwas posiada zdolności antyoksydacyjne 10x większe niż witamina E,zwiększa Nrf2 o 60% (jest to białko o działaniu antyoksydacyjnym i przeciwzapalnym posiadające dodatkowo właściwości chemoprewencyjne czyli ochronne w przypadku np.chemio czy radioterapi nowotworów)
– PCA obniża poziomy metaloproteinazy 2 (MMP2 – odpowiadają one międzyinnymi za bóle stawowe w niektórych infekcjach bakteryjnych np.w Boreliozie – conieco o metaloproteinazach pisałem juz kilka razy np. tutaj)
– PCA ma działanie antymelanogenezowe (zapobiega powstawaniu przebarwień skóry)
– PCA kontroluje poziomy glukozy, tłumi zaburzenia mitochondrialne w mózgu oraz zapobiega stresowi oksydacyjnemu w mózgu (badanie na szczurach z cukrzycą)
– PCA posiada właściwości ochronne dla wątroby i nerek w przypadku zatrucia kadmem
Ogólne działanie żółtlicy(bez wnikania w szczegóły tak jak wyżej):
Maść z tego ziela jest skuteczna w leczeniu trudno gojących się ran, owrzodzeń, oparzeń, wyprysków, suchego zapalenia skóry. Przed utarciem ziele najlepiej skropić alkoholem i gliceryną. Używane głownie było do leczenia ran, wyprysków, zmian troficznych skóry i jako środek wzmacniający oraz odżywczy. Doskonałe do leczenia ran, atopowego zapalenia skóry, łuszczycy, eczema, oparzeń, owrzodzeń jest utarte świeże ziele z olejem lnianym i tranem pół na pół. Jest dobra na kaszel. Posiada działanie antybakteryjne, przeciwzapalne, przeciwalergiczne, detoksyukjące, ochronne względem wątroby(hepatoprotekcyjne) i pobudza regeneracje tkanek. Posiada działanie przeciwwysiekowe,przeciwzapalne i regulujące przemianę materii. Pobudza naskórnikowanie i ziarninowanie, odtruwa skórę, wzmacnia włosy, podnosi wilgotność i elastyczność skóry. Przez H.Różańskiego polecany jest napar w postaci okładów na oczy przy cieniach i workach pod nimi oraz stanach zapalnych spowodowanych infekcją bakteryjną spojówek oraz powiek.
Dawkowanie
3-5x dziennie w postaci naparu
Podsumowanie:
Główne właściwości Żółtlicy na które zwróciłem uwagę to protekcja kluczowych organów (jelita i wątroba) jak i ich regeneracja oraz ochrona mitochondriów komórkowych. Jest to zioło stworzone wręcz do wsparcia walki z Helicobacter pylori oraz niwelujące skutki nadmiernie pobudzonego układu odpornościowego (częsty przypadek w niektórych infekcjach bakteryjnych jak Borelioza, Bartonella czy Brucelloza). Na dodatek wykazuje wielorakie funkcje w przypadku sporej ilości nowotworów co napewno nie jest bez znaczenia. No i najważniejsze – neuroprotekcja – zwłaszcza w przypadku mieliny aksonów(komórki Schwanna) co jest niezwykle istotne w przypadku chorób neurodegeneracyjnych. Jako, że może zwiększyć poziomy testosteronu i estradiolu niestety raczej odradzane do stosowania w fitoterapii u dzieci.
Post wydał Ci się wartościowy?a może po prostu mnie lubisz ;)?podziel się nim na Facebooku i go udostępnij!
Polub tego bloga na FB, gdzie znajdziesz też dodatkowe newsy, których tutaj nie publikuje https://www.facebook.com/zdrowiebeztajemnic
Obserwuj mnie na instagramie www.instagram.com/premyslaw84
Głosuj i wybieraj kolejne tematy – prawa strona bloga – zakładka „Ankieta”
archiwum.wiz.pl/2001/01043700.asp
ncbi.nlm.nih.gov/pubmed/21213993
ncbi.nlm.nih.gov/pubmed/26092182
ncbi.nlm.nih.gov/pubmed/20185303
ncbi.nlm.nih.gov/pubmed/18598177
pl.wikipedia.org/wiki/Inhibitory_konwertazy_angiotensyny
ncbi.nlm.nih.gov/pubmed/25097659
ncbi.nlm.nih.gov/pubmed/?term=6-demethoxy-ageratochrome
ncbi.nlm.nih.gov/pubmed/9005452
ncbi.nlm.nih.gov/pubmed/24370994
ncbi.nlm.nih.gov/pubmed/1615010
ncbi.nlm.nih.gov/pubmed/24066513
ncbi.nlm.nih.gov/pubmed/25233600
ncbi.nlm.nih.gov/pubmed/19772485
leafscience.com/2013/11/12/beta-caryophyllene-dietary-cannabinoid-make-synthetics-irrelevant/
ncbi.nlm.nih.gov/pmc/articles/PMC2449371/
ncbi.nlm.nih.gov/pubmed/27379721
ncbi.nlm.nih.gov/pubmed/11021645
ncbi.nlm.nih.gov/pubmed/18574142
ncbi.nlm.nih.gov/pubmed/12491040
ncbi.nlm.nih.gov/pubmed/16806628
pl.wikipedia.org/wiki/Bcl-2
ncbi.nlm.nih.gov/pmc/articles/PMC4005030/
ncbi.nlm.nih.gov/pubmed/25075424
ncbi.nlm.nih.gov/pubmed/25433806
ncbi.nlm.nih.gov/pubmed/25769424
ncbi.nlm.nih.gov/pmc/articles/PMC4337037/
ncbi.nlm.nih.gov/pubmed/19450673/
ncbi.nlm.nih.gov/pubmed/17705145/
ncbi.nlm.nih.gov/pubmed/26134310
ncbi.nlm.nih.gov/pubmed/26119854
ncbi.nlm.nih.gov/pubmed/25944785
ncbi.nlm.nih.gov/pubmed/17705145
ncbi.nlm.nih.gov/pubmed/19601677
ncbi.nlm.nih.gov/pubmed/19722571
ncbi.nlm.nih.gov/pubmed/20506690
ncbi.nlm.nih.gov/pubmed/20621462
ncbi.nlm.nih.gov/pubmed/20840540
ncbi.nlm.nih.gov/pubmed/20973550
ncbi.nlm.nih.gov/pubmed/21456600
ncbi.nlm.nih.gov/pubmed/21491470
ncbi.nlm.nih.gov/pubmed/21788573
ncbi.nlm.nih.gov/pubmed/22687555
ncbi.nlm.nih.gov/pubmed/23738793
ncbi.nlm.nih.gov/pubmed/24576555
ncbi.nlm.nih.gov/pubmed/26180584
ncbi.nlm.nih.gov/pubmed/26316260
ncbi.nlm.nih.gov/pubmed/26543754
ncbi.nlm.nih.gov/pubmed/26717920
ncbi.nlm.nih.gov/pubmed/26792397
ncbi.nlm.nih.gov/pubmed/27226100
ncbi.nlm.nih.gov/pubmed/24210682
Probiotyki – ich właściwości i wpływ na układ immunologiczny

Temat probiotyków jest tak rozległy, że można by było o nich napisać kilkutomową encyklopedię. Przerobiłem przeogromną ilość literatury ogólnodostępnej na ten temat w poszukiwaniu ich bezpośredniego wpływu na układ immunologiczny (zależało mi na szczegółowych właściwościach poszczególnych szczepów). W trakcie studiowania immunologicznych aspektów pożytecznych bakterii, pogłębiłem również swoją wiedzę na temat ogólnych ich właściwości , którą chciałbym się teraz z Tobą podzielić. Temat rozbije zatem na 2 posty, aby trochę łatwiej się to studiowało.
Probiotyki uszczelniają ogólnie rzecz biorąc ściany nabłonka jelitowego tak, aby nie przedostawały się przez niego do krwi szkodliwe substancje, poprawiają funkcjonowanie śluzówki układu pokarmowego, stymulują działanie układu odpornościowego, syntetyzują substancje odżywcze i ułatwiają ich biodostępność, łagodzą objawy nietolerancji laktozy, redukują ryzyko pojawienia się alergii u obciążonych nim osób oraz zmniejszają prawdopodobieństwo wystąpienia niektórych nowotworów.
Specyficzną cechą niektórych bakterii probiotycznych jest ich zdolność przedostawania się w stanie żywym do jelita grubego, osiedlania się w nim i rozmnażania. Oddziałują one korzystnie na stan zdrowotny przewodu pokarmowego, a w konsekwencji na stan naszego zdrowia.
Istnieje coś takiego jak jelitowy układ nerwowy który składa się z setek milionów komórek nerwowych zdolnych do porozumiewania się i do przekazywania informacji do mózgu jak i innych organów. Układ ten znajduje się w jelicie cienkim,żołądku, trzustce czy też pęcherzyku żółciowym. Pełni on takie funkcję jak(między innymi):
– regulacja perystaltyki, ruchów jelitowych, skurczów mięśniówki jelit
– wydziela enzymy trawienne, które rozdrabniają pożywienie na małe cząsteczki
– uczestniczy w regulacji ruchów perystaltycznych przełyku, pomagając przesunąć pożywienie do żołądka
– ruchy perystaltyczne pęcherzyka pozwalają na wydzielenie żółci do dwunastnicy
– pomaga w wydzielaniu hormonów uwalniających enzymy trzustki
– zmienia wydzieliny i elektrolity w przewodzie pokarmowym
– towarzyszy przepływowi krwi przez śluzówkę jelit
– reguluje pracę zwieraczy przewodu pokarmowego i przełyku, zapobiegając cofaniu się pokarmu do jamy ustnej i pozwalając przesuwać go z żołądka do dwunastnicy (tj.zapobiega objawom refluksu)
– używa praktycznie wszystkich neuroprzekaźników do funkcjonowania w tym serotoninę, GABA, dopaminę czy acetylocholinę
W 2011 roku Journal of Neurogastroenterology opublikowało arta z którego wynikało, że bifidobacteria longum pobudza wew.układ nerwowy i wysyła sygnały, które aktywują ścieżkę nerwu błędnego na poziomie jelitowego układu nerwowego – dowodzi to bezpośredniego związku aktywności i ilości bakterii jelitowych na zachowanie i naturalnie zdrowie człowieka.
Udowodniono że nieszczelność jelit, infekcja przewodu pokarmowego i depresja są ze sobą powiązane poprzez przepływ bakterii i patogenów jelito->mózg i zmianę w funkcji neuroprzekaźników. Przykład?powiązanie streptococusa z nerwicą natręctw i zespołem Touretta jak i związany z tym dysbalans immunologiczny wywołujący anginę czy też infekcję mózgu.
Naukowcy dowiedli, że brak balansu pomiędzy złymi a dobrymi bakteriami układu trawiennego ma duży udział w rozwoju przewlekłych schorzeń, takich jak choroby autoimmunologiczne, zespół metaboliczny, cukrzyca, otyłość, zespół przewlekłego zmęczenia czy niealkoholowe stłuszczenie wątroby. Suplementacja dobrych bakterii zapewnia ochronę przed chorobami jelitowymi, takimi jak zapalenie jelit(IBD), zespół jelita drażliwego (IBS) i nowotwór jelita grubego czy też powstrzymuje nadmierne starzenie się organizmu.
Ocenia się, że w jelitach znajduje się ok.100 trylionów mikroorganizmów, 400-1000 różnych gatunków bakterii i jest to ok.80% całkowitej obrony immunologicznej organizmu. W badaniach wykazano, że podczas karmienia piersią następuje wytworzenie się(implantacja) flory bakteryjnej w jelitach noworodka – karmienie piersią znacznie zmniejszyło ryzyko wystąpienia astmy wieku dziecięcego. Karmienie piersią przez ok.12 miesięcy zabezpiecza przed rozwojem RZS a zbyt krótkie karmienie może spowodować rozwój nadbopudliwości u dzieci – ADHD. Naturalnie każdy probiotyk ma swoje indywidualne właściwości, które ogólnikowo i w niektórych przypadkach szczegółowo chciałbym scharakteryzować.
– Bifidus infantis 35624 – może powodować zmniejszenie depresji, redukuje zespół jelita drażliwego.
Laktobacilus reutris – cofa stany antylękowe a także silnie pobudza układ immunologiczny (zwłaszcza cytokinę zapalną TNF alfa co jest bardzo niekorzystne u ludzi z RZS,Crohnem i ogólnie u wszystkich z autoagresję w tym i naturalnie Hashimoto). Powoduje zmianę aktywności neuroprzekaźnika GABA w układzie nerwowym.
– Lactobacillus rhamnosous – likwiduje stres, lęki i depresję
Lactobacillus Helveticus – likwiduje stres, lęki i depresję
– Bifidus lopngus – likwiduje stres, lęki i depresję
– Pałeczki Lactobacillus i Bifidobacterum ułatwiają proces trawienia białek, cukrów(prostych i złożonych) oraz tłuszczów, zwiększają absorbcję witamin i minerałów, zwiększają oporność fizjologiczną mikroflory bakteryjnej na działanie antybiotyków, łagodza odczyny zapalne wywołane przez bakteri, grzyby(Candida) i wirusy(np. biegunki wywołane przez rotawirusy), osłabiają reakcje alergiczne, wzmagają antybakteryjne i antygrzybiczne czy też antywirusowe reakcje odpornościowe, mają działanie przeciwnowotworowe, redukują eliminacje produktów katabolizmu białek, tłuszczów i węglowodanów przez nerki i wątrobę, zmniejszają poziom cholesterolu w surowicy i ograniczają osteoporozę.
Wyniki badań naukowych odkryły związek pomiędzy różnymi szczepami Lactobacillus (Lactobacillus acidophilus, Lactobacillus paracasei i Lactobacillus rhamnosus) oraz wzrostem cholesterolu HDL. Wykryto również powiązanie pomiędzy szczepami Bifidobacterium (Bifidobacterium lactis, Bifidobacterium bifidum i Bifidobacterium longum) a poprawą kontroli cukru we krwi, zmniejszeniem stanów zapalnych wątroby i redukcją uszkodzeń DNA, które mogą powodować rozwój komórek nowotworowych.
Wpływ bakterii probiotycznych na reakcje odpornościowe
Najliczniej reprezentowane w mikroflorze jelitowej sa takie gatunki jak Bacterioides, Eubacterium, Peptostreptococcus, pałeczki rodziny Enterobacteriacae, Bifidobacterium, Streptococcus, Lactobacillus, Clostridium i Staphylococcus. Niektóre z tych drobnoustrojów są patogenne, a inne wywierają korzystne działanie. Dlatego kolonizacja układu pokarmowego przez określone gatunki drobnoustrojów ma znaczny wpływ na ogólne uwarunkowania zdrowotne (podatność na infekcje, alergie, efekty toksyczne i karcynogenne). Takie czynniki jak: wiek, przyzwyczajenia żywieniowe, stan immunologiczny, stosowanie antybiotyków, stres, alkohol, oraz pH treści jelitowej, czasokres pasażu treści pokarmowej i jej skład wpływają na skład mikroflory jelitowej i jej aktywności metaboliczne.
Probiotyki a układ odporności wrodzonej
Bakterie probiotyczne wpływają stymulująco na układ odporności naturalnej poprzez: a) wzmaganie aktywności fagocytarnej granulocytów oraz makrofagów oraz ich właściwości bójczych i cytostatycznych, b) aktywację komórek natural killers-NK(o których pisałem już tutaj), c) indukcję syntezy cytokin zapalnych jak i przeciwzapalnych, d) modulację zdolności prezentacji antygenu limfocytom T
Zwiększanie aktywności enzymatycznej i fagocytarnej makrofagów i granulocytów
Wzmaganie przez probiotyki aktywności enzymatycznej i fagocytarnej makrofagów i granulocytów obserwowano zarówno in vitro, tj. po ich dodaniu do hodowli zawierających te komórki jak i in vivo – iniekcja dootrzewnowa (u myszy) i podanie doustne (u myszy i człowieka). Pozytywny efekt uzyskiwano zarówno przy zastosowaniu żywych szczepów bakterii probiotycznych jak i zabitych bakterii lub ich produktów. Efektywność działania zależy od zastosowanych szczepów bakterii i drogi ich podania, tj. parenteralnie lub per os. Np. u myszy już w 2 dni po podaniu dootrzewnowym L.bulgaricus 10-krotnie zwiększał się poziom enzymów lizosomalnych §-galaktozydazy, §-glukuronidazy, dehydrogenazy mleczanowej) w makrofagach, przy czym żywe bakterie wywoływały większy efekt niż martwe. Szczep L.casei był mniej efektywny (tylko 3-krotny wzrost poziomu enzymów), przy użyciu żywych i martwych bakterii. Oba szczepy podane per os były jednakowo efektywne, indukując większą aktywność enzymatyczną makrofagów w przypadku użycia żywych bakterii. W 2 dni po podaniu dootrzewnowym L.bulgaricus kilkakrotnie zwiększała się aktywność fagocytarna makrofagów, utrzymując się na tym poziomie do 8 dnia; przeciwnie, po podaniu per os fagocytoza wzrastała tylko nieznacznie, natomiast L.casei podane dootrzewnowo jak i per os jednakowo wzmagały fagocytozę.
Dootrzewnowe podanie L.casei zwiększało także aktywność fagocytarną komórek układu siateczkowo-śródbłonkowego. Wzrost aktywności fagocytarnej i enzymatycznej makrofagów wywoływały nie tylko żywe lub martwe pałeczki Lactobacillus, lecz także ich produkty: a) ekstrakty białkowe Bidobacterium longum, lecz nie L.acidophilus zwiększały poziom fosfodiesterazy alkalicznej (hydrolaza) w makrofagach; ekstrakty z obu szczepów jednakowo wzmagały fagocytozę cząsteczek akrylamidu lub żywych bakterii S.typhi murium, b) fosfopolisacharydy pochodzące ze szczepu L.dulbrueckii ssp. bulgaricus, podane dootrzewnowo, zwiększały zarówno liczbę makrofagów, ich aktywność cytostatyczną wobec linii komórek nowotworowych: sarcoma – 180 oraz P388, oraz aktywność fagocytarną (cząsteczek lateksu). L.casei był bardziej efektywny aniżeli L.bulgaricus.
Aktywacja komórek NK
Niektóre szczepy jak Bidobacterium lactis HN019 oraz L.rhamnosus HN001 u człowieka, lub szczepy L.rhamnosus HN001, DR20TM, L.acidophilus HN017, Bifidobacterium lactis HN019 na modelu mysim silnie zwiększały ilość komórek natural killers NK, które wykazywały wzmożony efekt cytotoksyczny in vitro wobec linii komórek nowotworowych K-562.
W pełni zdrowy system immunologiczny jelit faworyzuje produkcję immunoglobuliny IgA oraz cytokin z grupy limfocytów Th2 niż Th1 – innymi słowy bardziej wycisza niż nasila procesy zapalne. Jednak w przypadku takich chorób jak wrzodzejące zapalenie jelita grubego (które spowodowane jest nadreaktywnością limfocytów Th2) czy też choroba Lesniowskiego-Crohna(zwiększone wytwarzanie cytokin prozapalnych limfocytów Th1) pokazują wyraźną dominację Th1 lub Th2.
Wszystkie bakterie probiotyczne są w stanie pobudzić wytwarzanie określonych cytokin – np. Lactobacillus sakei wzmaga produkcję zapalnych cytokin IL-1, IL-8 oraz TNF. Z kolei Lactobacillus Johnsonii wzmaga produkcję -beta(o tej cytokinie pisałem już wcześniej tutaj). Udowodniono również, że poszczególne szczepy bakteri mają najróżniejsze oddziaływanie na system odpornościowy takie jak np. zwiększenie fagocytozy czy aktywności komórek NK(troche więcej o tych komórkach pisałem już tutaj).
Balansowanie syntezy cytokin
Wiele szczepów pałeczek Lactobacillus po kontakcie in vitro z populacją jednojądrzastych komórek ludzkiej krwi obwodowej aktywuje te komórki do syntezy cytokin zapalnych, takich jak TNF-alfa, IL-6, IL-10, IL-12, IL-18, IFN-gamma. Wszystkie one (z wyjątkiem IL-10) należą do tzw. „prozapalnych” cytokin typu Th1. Zakres ich syntezy zależy od stosowanego szczepu Lactobacillus. Niektóre szczepy jak L.rhamnosus, B.animalis czy L.acidophilus były silnymi induktorami TNF-alfa i IL-6 in vitro, a inne (B.longum, B.lactis L.paracasei, E.lactis) słabymi.
Większość z badanych szczepów pałeczek Lactobacillus wzmagała syntezę cytokiny IL-10(zmniejsza stany zapalne) in vitro w podobnym zakresie ilościowym.
Podawanie probiotyków per os w postaci zawiesiny bakterii lub w mleku fermentowanym wzmagało prozapalne aktywności leukocytów krwi obwodowej manifestujące się poprzez: a) samoistną syntezą Interferonu-gamma w hodowli leukocytów in vitro, b) zwiększoną poziom interferonów (IFN-alfa i IFN-gamma) c) wzrost poziomu Interferonu-gamma w surowicy. Nie zidentyfikowano komórek odpowiedzialnych za te aktywności. Prawdopodobnie były to komórki NK lub/i limfocyty T. Podawanie priobiotyków per os wzmagało też zdolność limfocytów krwi obwodowej do syntezy IL-2(cytokina zapalna) po aktywacji tych komórek in vitro przez mitogeny limfocytów T. Wyniki te wskazują, że probiotyki mogą wzmagać niektóre prozapalne aktywności limfocytów (synteza cytokin Th1).
Czy jest to pożądane zjawisko? Z jednej strony tak, ponieważ obecność tych cytokin determinuje działanie antyinfekcyjne (antywirusowe i antybakteryjne). Z drugiej strony nie, ponieważ może powodować nadmierne reakcje zapalne, co w warunkach in vivo jest niekorzystne(zwłaszcza jeśli chodzi o choroby autoimmunologiczne). Cytokiny mają bowiem decydujące znaczenie efektorowe (wzmaganie wielu komórkowych reakcji odpornościowych) jak i regulacyjne (zachowanie równowagi czynnościowej pomiędzy pro i przeciwzapalnymi reaktywnościami komórek układu odpornościowego, tj. odpowiednio Th1 i Th2 zależnymi).
Regulacja poziomu i profilu cytokin syntetyzowanych komórki układu odpornościowego przez bakterie probiotyczne w znacznej mierze zależy od kompozycji gatunków i szczepów danego gatunku oddziałowujących na komórki układu odpornościowego. Np. kombinacja szczepów L.acidophilus, L.bulgaricus i B.bifidum, wchodzących w skład preparatu Trilac (Alergon, Gšteborg, Szwecja), zwiększa wytwarzanie TNF-alfa (cytokina prozapalna) i IL-10 (przeciwzapalna), przy praktycznie braku IFN-gamma i niskim poziomie IL-12 (cytokiny zapalne). Przeciwnie, L. acidophilus z tego samego preparatu, jest silnym induktorem IL-12, IFN-gamma, i TNF-alfa przy słabej aktywności IL-10(w pojedynkę zatem wzmaga stany zapalne). Tak więc odpowiednia kombinacja szczepów pałeczek Lactobacillus determinuje ich probiotyczne właściwości w odniesieniu do reakcji odpornościowych, manifestujace się: a) słabą aktywnością prozapalną (słaba aktywność IL-12, IFN-g), b) możliwością działania antyinfekcyjnego (poprzez aktywności TNF-alfa), c) działaniem przeciw zapalnym (poprzez IL-10). Potwierdzeniem tych obserwacji były badania in vivo, wykazujące że tylko nieliczne szczepy Lactobacillus podane per os (tutaj L.reuteri i L.brevi) wywoływały u myszy syntezę prozapalnych cytokin w obrębie kosmków jelitowych.
– l.casei,l.salirarius, lactobactilus raumosus, bifidobacterium bactis, l.reuteri zwiekszają poziom limfocytów th2(przeciwzapalne właściwości)
– bifidobacterium bifidum, bifidobacterium animals zwiekszaja th1 i stan zapalny
– Lactobacillus acidophilus szczep 0356, Lactobacillus plantarum, Lactobacillus paracaseii szczep NCC2461 – zwiększają poziomy limfocytów Th1
– Lactobacillus acidophilus szczep La-14 IgG i Lactobacillus acidophilus szczep NCFM IgA, IgM – zwiększają limfocyty Th2 (czyli odpowiedz przeciwzapalną)
– Lactobacillus paracasei – DSM13434, Lactobacillus plantarum – DSM15312, Lactobacillus plantarum – DSM15313 – modulują tj.balansują cały układ odpornościowy(poprzez limfocyty T regulacyjne)
Bakterie fermentacji mlekowej:
Lactobacillus acidophilus to względnie beztlenowa pałeczka Gram-dodatnia. Wraz z kilkunastoma innymi gatunkami bakterii rodzaju Lactobacillus powszechnie zasiedla środowisko roślinne i zwierzęce, a także wchodzi w skład naturalnej flory przewodu pokarmowego człowieka. Występuje w mikroflorze jamy ustnej, we wszystkich odcinkach przewodu pokarmowego, w układzie moczowo-płciowym, a szczególnie często kolonizuje pochwę u kobiet. Najczęściej identyfikowane gatunki oprócz Lactobacillus acidophilus to: Lactobacillus casei i Lactobacillus fermenrum. Bakterie te powszechnie nazywane bakteriami kwasu mlekowego są również wykorzystywane w przemyśle spożywczym do przeprowadzania fermentacji mleka i produkcji jogurtów czy kefirów. Współczesne obserwacje potwierdzają, że zarówno ludzie jak i zwierzęta nie posiadające w przewodzie pokarmowym bakterii kwasu mlekowego są bardziej podatne na zakażenia jelitowe, powodujące w konsekwencji zaburzenia równowagi drobnoustrojowej przewodu pokarmowego gospodarza. Z kolei powstałe zaburzenia w składzie flory fizjologicznej układu trawiennego prowadzą do:
Eliminacji naturalnych producentów witamin z grupy B czy K oraz upośledzenie wchłaniania wapnia i przyswajania żelaza. Dysbakteriozy, czyli do nadmiernego namnażania – wobec braku naturalnej konkurencji – bakterii patogennych oraz nadkarzania bakteriami i grzybami. Skutkiem tego jest upośledzenie procesów wchłaniania tłuszczów oraz wzmożone wydalanie tłuszczów z kałem. Poza tym wzrost stężenia kwasów żółciowych i wzrost stężenia nie wchłoniętych produktów prowadzi do podrażnienia śluzówki przewodu pokarmowego i do utraty wody i elekrolitów, czyli biegunki. Dochodzi również do zaburzenia wchłaniania białek, węglowodanów i wzrostu procesów fermentacyjnych. Rzekomo błoniastego zapalenia jelita grubego wywołanego przez Clostridium difficile, którego pierwotną przyczyną jest przewlekła antybiotykoterapia. Antybiotyki, które najczęściej wywołują poantybiotykowe zapalenie jelit to: neomycyna, linkomycyna, klindamycyna i cefazolina.
Lactobacillus acidophilus ma zdolność zapobiegania i leczenia tych zaburzeń na drodze hamowania rozwoju bakterii patogennych.
Wykazano, że Lactobacillus działają antagonistycznie na pałeczki Gram-ujemne, takie jak: Shigella, Salmonella, Klebsiella, Escherichia colli; na ziarenkowce Gram-dodatnie, takie jak np. gronkowiec złocisty i na grzyby np. Candida albicans.
Lactobacillus acidophilus ma zdolność neutralizowania amin toksycznych i hamowania procesów gnilnych w jelicie i na tej drodze również przywraca równowagę drobnoustrojową przewodu pokarmowego.
Istnieją także wstępne badania, zakończone bardzo pozytywnymi wynikami, na temat redukcji poziomu cholesterolu dietą zawierającą pałeczki Lactobacillus acidophilus.
Udokumentowano również stymulujący wpływ Lactobacillus acidophilus na układ odpornościowy, polegający na wzroście aktywności makrofagów i limfocytów. Efektem tego jest wzrost siły i skuteczności odpowiedzi typu komórkowego układu odpornościowego(th1)
Z szeregu wymienionych, cennych właściwości jakie posiada Lactobacillu acidophilus i inne pałeczki kwasu mlekowego wynikają wskazania do jej zastosowania (z wyłączeniem osób z autoagresją układu immunologicznego). Są to wszystkie stany, które zaburzają równowagę flory bakteryjnej przewodu pokarmowego takie jak:
antybiotykoterapia, sterydoterapia, głodzenie, zatrucie pokarmowe, antykoncepcja doustna, zapalenia jelit spowodowane bytowaniem złych bakteri (krótkotrwała kuracja tylko po to aby przywrócić równowagę mikroflory bakteryjnej z tego względu iż acidophilus wzmaga syntezę cytokin zapalnych), nadużywanie alkoholu, nadużywanie kofeiny, chlorowana i fluorowana woda, stres, Są to również te stany, w których zostaje zaburzona równowaga flory bakteryjnej w innych miejscach bytowania pałeczki kwasu mlekowego: zakażenia układu moczowego, zakażenia układu płciowego.Na szczególną uwagę zasługuje bardzo duża skuteczność Lactobacillus acidophilus w leczeniu zakażeń grzybami Candida albicans o których pisałem już tu, tu, tu, i tu.
Grzybica może rozwinąć się w wyniku zastosowanej antybiotykoterapii lub pod wpływem jednego z czynników wymienionych powyżej i doprowadza do biegunki, zaparć lub innych zaburzeń trawienia. Grzybica może pojawić się poza przewodem pokarmowym np.: w płucach, na rękach, nogach, palcach, pod paznokciami bądź w pochwie. Także trądzik i inne problemy skórne mogą być leczone przez Acidophilus.
Pożyteczne bakterie i ich prozdrowotne właściwości w organiźmie kobiety
Bakteryjne szczepy Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C posiadają właściwości, dzięki którym wywierają korzystne działanie w organizmie kobiety.
Według ekspertów z Organizacji Narodów Zjednoczonych ds. Wyżywienia i Rolnictwa (FAO) i Światowej Organizacji Zdrowia (WHO) w przypadku probiotyków ginekologicznych wskazane jest zastosowanie w preparacie dwóch lub więcej szczepów probiotycznych.Szczepy Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C zostały wyizolowane z pochwy zdrowej kobiety jako naturalna triada, gdzie współdziałały
przy wywieraniu korzystnych efektów. Już pochodzenie tych szczepów sprawia, że są one dedykowane specjalnie dla kobiet.
Wykazano, że istnieją różnice w składzie mikroflory pochwy kobiet pochodzących z różnych regionów geograficznych. Dlatego też należy zwracać uwagę, czy bakterie probiotyczne pochodzą z rejonu, w którym są stosowane przez pacjentki. Mikroflora pochwy zdrowych Polek jest zdominowana głównie przez szczepy bakterii należące do tzw. kompleksu Lactobacillus acidophilus (35%), w tym Lactobacillus gasseri oraz szczepy Lactobacillus fermentum (30%) i Lactobacillus plantarum (30%). Tak więc szczepy Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C, które zostały wyizolowane z pochwy zdrowej Polki, są idealne dla polskich kobiet.
Aby szczepy probiotyczne mogły wywierać korzystny wpływ na zdrowie gospodarza muszą nie tylko zostać do niego dostarczone, ale również muszą zasiedlić jego organizm. Zasiedlenie jest możliwe dzięki adherencji komórek bakterii, która następuje poprzez ich łączenie się z odpowiednimi receptorami zlokalizowanymi na powierzchni komórek gospodarza. Adherencja do tkanki umożliwia rozwój i namnażanie się bakterii probiotycznych, a kolonizacja tkanek znacząco obniża ryzyko zasiedlenia skolonizowanych tkanek przez mikroorganizmy patogenne.
W badaniach wykazano, że bakteryjne szczepy Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C posiadają zdolność do adherencji zarówno do komórek linii komórkowej nabłonka pochwy A431, jak również do komórek linii Caco-2 i linii HT-29 MTX, które reprezentują komórki nabłonka jelitowego. Jest to cecha,która umożliwia wspomnianym szczepom kolonizację nabłonka pochwy i odbytu, co zostało udowodnione w przeprowadzonych badaniach klinicznych. Niezwykle korzystną dla probiotyków cechą jest zdolność do koagregacji, która sprzyja kolonizacji środowiska oraz tworzeniu biofilmu. W trakcie przeprowadzonego badania klinicznego potwierdzono występowanie zjawiska koagregacji pomiędzy komórkami szczepów bakteryjnych Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C. Wykazują one zwiększoną skuteczność kolonizacji środowiska, pokonując wspólnie niesprzyjające warunki w nim panujące.
Ważną cechą bakterii kwasu mlekowego jest działanie antagonistyczne względem patogennych bakterii i grzybów. Odbywa się ono m. in. na drodze konkurencji o składniki odżywcze, syntezę swoistych związków antybakteryjnych (m.in. bakteriocyn), czy obniżanie pH środowiska poprzez produkcję kwasu mlekowego. Ponadto bakterie z rodzaju Lactobacillus blokują miejsca adherencyjne występujące na powierzchni nabłonka, co
w znaczącym stopniu uniemożliwia jego zasiedlanie przez mikroorganizmy patogenne. Badania naukowe wykazały, że mieszanina szczepów Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C wykazuje właściwości antagonistyczne względem bakterii i grzybów patogennych, m.in. takich jak uropatogenny szczep Escherichia coli, Streptococcus agalactiae, Gardnerella vaginalis, Prevotella bivia, Candida albicans, będących najczęstszą przyczyną infekcji układu moczowo-płciowego, jak również Clostridium difficile, Staphylococcus aureus i Enterococcus faecalis. Ponadto omawiane szczepy probiotyczne mają zdolność do hamowania adhezji patogenów do powierzchni komórek linii komórkowej nabłonka pochwy A431, ograniczając w ten sposób możliwość rozwoju infekcji.
Zdolność przetrwania układu pokarmowego
Sok żołądkowy i sole żółci wytwarzają warunki, w których nie wszystkie bakterie są w stanie przeżyć. Bakterie, które nie są odporne na działanie takich czynników, nie przetrwają pasażu jelitowego, nie zasiedlą miejsca docelowego, a w konsekwencji nie będą korzystnie oddziaływały na organizm gospodarza. Oporność na działanie soli żółci i sztuczny kwas żołądkowy jest cechą charakteryzującą szczepu Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C, które, dzięki tym właściwościom, przeżywają pasaż jelitowy i mogą pełnić swoje funkcje w organizmie gospodarza.
Niezwykle skutecznym mechanizmem antagonistycznego działania bakterii kwasu mlekowego względem patogennej flory pochwy jest produkcja nadtlenku wodoru. Nadtlenek wodoru produkowany przez bakterie z rodzaju Lactobacillus może hamować wzrost bakterii, szczególnie beztlenowych. Bakterie produkujące nadtlenek wodoru są niezwykle istotnym składnikiem mikroflory zdrowej pochwy, a ich liczebność zdecydowanie maleje w przypadku przewlekłych stanów zapalnych pochwy oraz w okresie ciąży. Brak w środowisku pochwy bakterii produkujących nadtlenek wodoru wiąże się ze zwiększoną częstością występowania nawrotowych bakteryjnych waginoz pochwy. Dlatego też organizacje FAO i WHO zalecają, aby szczepy kolonizujące pochwę posiadały zdolność produkcji nadtlenku wodoru. Badania wykazały, że szczep Lactobacillus gasseri 57C należy do elitarnej grupy bakterii posiadającej tą pożądaną dla probiotyków zdolność.
Istotną właściwością probiotyków ginekologicznych, zalecaną przez Organizację Narodów Zjednoczonych ds. Wyżywienia i Rolnictwa (FAO) oraz Światową Organizację Zdrowia (WHO), jest oporność na działanie środków plemnikobójczych. W badaniach wykazano, że preparat zawierający szczepy Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C wykazuje oporność na działanie spermicydu, jakim jest nonoksynol-9 . Ponadto, probiotyczne szczepy Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C wykazują typową dla gatunków lekooporność. Są oporne na metronidazol, ciprofloksacynę, norfloksacynę i kwas nalidyksowy i mogą być skutecznie stosowane m.in. w trakcie terapii wspomnianymi antybiotykami i chemioterapeutykami.
Rola probiotyków w leczeniu nowotworów
Naukowcy wykazali, że organizmy probiotyczne włączają ochronne mechanizmy sygnalizacyjne, które:
– tłumią bakterie, które przekształcają cząsteczki pro-nowotworowe w karcenogenne
– wiążą się z potencjalnymi karcenogenami, wspomagając ich wydalanie
– redukują enzymy związane z rozwojem czynników nowotworotwórczych
– zwiększają populację komórek odpornościowych, które odgrywają istotną rolę w hamowaniu nowotworów
– regulują immunologiczne cytokiny do walki na wczesnym stadium nowotworu lub innych zagrożeń(ważny jest dobór odpowiednich typów i szczepów bakteri)
– tłumią reakcję zapalną gdy słabnie zagrożenie infekcją czy nowotworem(ważny jest dobór odpowiednich typów i szczepów bakteri)
Odpowiednio zbilansowana flora bakteryjna wytwarza biologicznie aktywne białka, które przedostają się do krwi. W ten sposób, „dobre” bakterie hamują rozwój licznych chorób przewlekłych, wliczając w to otyłość, cukrzycę, zespół metaboliczny, choroby sercowo-naczyniowe, nowotwory czy infekcje układu oddechowego. Dzisiejsza dieta, styl życia, praktyki lekarskie i inne czynniki mają tendencję do zakłócania równowagi bakteryjnej jelit.
Dowody wskazują, że suplementacja kluczowych szczepów przywraca odpowiednią równowagę korzystnych bakterii, co z kolei odbudowuje naturalną funkcję jelit, chroniącą przed wieloma chorobami.
Lactobacillus i Bifidobacteria, dwa najlepiej poznane gatunki, jak wykazano, wspomagają funkcjonowanie jelit oraz okazują się być pomocne w leczeniu zarówno biegunki jak i zaparć.
Cukrzyca i zespół metaboliczny. Jak wykazano podczas badań klinicznych przeprowadzonych na ludziach oraz zwierzętach, probiotyki zawierające Lactobacillus i Bifidobacteria wpłynęły na poprawę insulinooporności i znaczne zmniejszenie stężenia cukru we krwi. Podczas 6-tygodniowej próby, wśród pacjentów z cukrzycą typu II, badanie na czczo glukozy oraz hemoglobiny A1c (miara długoterminowej kontroli cukru we krwi) uległy znacznej poprawie dzięki spożywaniu jogurtów probiotycznych zawierających Lactobacillus acidophilus i Bifidobacterium lactis. Odnotowano również wzrost całkowitego poziomu antyoksydantów.
Otyłość. Istnieje związek pomiędzy nadużywaniem antybiotyków a otyłością. Badania przeprowadzone na zwierzętach oraz ludziach wykazały, że suplementacja probiotyków wspomaga redukcję wagi ciała i gromadzenia tłuszczu. Podczas prób zaobserwowano, że probiotyki podawane matkom w okresie prenatalnym , wywołały redukcję przyrostu masy u kobiet oraz ich dzieci.
Choroby układu sercowo-naczyniowego. Jak wykazały wyniki badań przeprowadzonych na ludziach oraz zwierzętach, stosowanie probiotyków zmniejsza poziom cholesterolu całkowitego oraz LDL a zwiększa HDL. Ostatnie próby sugerują, że suplementacja dobroczynnych bakterii może zmniejszyć wchłanianie cholesterolu oraz zredukować stany zapalne związane z magazynowaniem tłuszczu. Zmiany te przyczyniają się do znacznego zmniejszenia powstawania zapalnych, miażdżycowych, obciążonych cholesterolem płytek obserwowanych w początkowym stadium miażdżycy.
Nowotwór. Przyjmowanie bakterii probiotycznych może zredukować ryzyko powstawania nowotworów, w szczególności okrężnicy. Naukowcy wykazali, że suplementacja Lactobacillus acidophilus i Bifidobacterium longum, znacznie zmniejsza uszkodzenia DNA, które mogą powodować rozwój komórek złośliwych – co potwierdza redukcja związków przerywających nici DNA w ludzkim kale. Uzupełnianie korzystnych bakterii za pomocą suplementacji zwiększa naturalne, antyoksydacyjne i detoksykacyjne enzymy, które zapobiegają aktywacji potencjalnych substancji nowotworotwórczych pochodzących z diety.
Ponadto, jak wykazano wśród pacjentów cierpiących na nowotwór jelita grubego oraz osób z przednowotworowymi polipami, suplementacja synbiotyków (bakterii probiotycznych w połączeniu z prebiotykami , substancjami, które je promują i odżywiają), spowodowała znaczną redukcję proliferacji nieprawidłowych komórek jelita grubego i zmniejszenie poziomu szkodliwych bakterii Clostridium.
Infekcje dróg oddechowych. Probiotyki mogą znacznie zahamować wiele rodzajów infekcji dróg oddechowych, takich jak powszechne przeziębienia czy grypa, zwłaszcza jeśli suplementację rozpocznie się przed sezonem zachorowań. Według badań, 3-6 miesięczna suplementacja różnych szczepów bifidobakterii i Lactobacillus zmniejsza czas trwania objawów średnio od jednego do dwóch lub nawet kilku dni, podobnie jak w przypadku redukcji nasilenia objawów. Podczas dwóch prób przeprowadzonych na dzieciach, które otrzymywały zarówno Lactobacillus i Bifidobacterium dwa razy dziennie przez okres od 3 do 6 miesięcy, stwierdzono znaczny spadek nieobecności w szkole i konieczności przyjmowania antybiotyków, podobnie jak w przypadku redukcji i czasu trwania objawów choroby.
Regularne stosowanie probiotyków, zmniejsza o 19% kolonizację potencjalnie patogennych bakterii w nosie, będących powszechnym powikłaniem przeziębienia, podczas gdy w grupie kontrolnej nie wykazano żadnych zmian. Efekt ten może uratować życie osobom starszym, jak i pacjentom cierpiącym na osłabiony układ odpornościowy z powodu przewlekłych chorób, jak np. cukrzyca, czy przebycia poważnej operacji, ponieważ są one w grupie zwiększonego ryzyka śmierci w wyniku infekcji bakteryjnej, szczególnie zapalenia płuc.
Antybiotyki. Jedną z przyczyn zaburzenia równowagi pomiędzy dobrymi a złymi bakteriami jest niepotrzebne stosowanie antybiotyków. Nawet niewielkie ilości, poniżej dawki terapeutycznej, mogą zakłócić liczbę i relatywne proporcje bakterii jelitowych. Preparaty dla niemowląt. Powszechne ich stosowanie, zamiast karmienia mlekiem matki, zrywa z długą historią przekazywania bakterii z kobiety na dziecko. Podobnie, poród cesarskim cięciem zapobiega dziedziczeniu przez noworodka różnych bakterii.
Nadmierna higiena. Obsesja na tle higieny drastycznie redukuje zdolność do naturalnego nabywania pewnych kluczowych bakterii z naszego środowiska.
Zachodnia dieta, która jest pełna białka zwierzęcego oraz tłuszczów, cukru i rafinowanych węglowodanów powoduje wzrost niepożądanych bakterii. Przykładem może być wzrost bakterii Firmicutes związanych z otyłością. Na wiele posiłków diety zachodniej składają się rafinowane węglowodany, które są wchłaniane w górnej części przewodu pokarmowego. Ostatecznie, do jelita grubego dociera mikroflora o ograniczonej wartości, gdyż zawiera jedynie niewielką ilości minerałów, witamin i innych składników pokarmowych niezbędnych do jej utrzymania. W efekcie, liczba i różnorodność korzystnych bakterii jelitowych jest znacznie ograniczona, w porównaniu z dietą ludzi żyjących w czasach paleolitu.
Jak zaobserwowano, w porównaniu z osobami zdrowymi, u pacjentów w stanie krytycznym, często wykazuje się 10000 razy mniej m.in. bakterii Bifidobacterium i Lactobacillus. Ujawnia się u nich również 100 razy więcej patogenicznych (chorobotwórczych) bakterii, takich jak Staphylococcus. Co więcej, wśród osób ze znacznie ograniczoną populacją i różnorodnością mikroflory w połączeniu z obecnością dużych ilości enterokoków, niewydolność narządów czy śmiertelność na oddziałach intensywnej opieki jest bardziej powszechna.
Zaburzenia równowagi flory jelitowej, jak udowodniono, upośledza zdolność organizmu do utrzymania integralności śluzówki błon, warstw ochronnych, które zapobiegają wniknięciu patogenów do narządów i jamy ciała.
Post wydał Ci się wartościowy?a może po prostu mnie lubisz ;)?podziel się nim na Facebooku i go udostępnij!
Polub tego bloga na FB https://www.facebook.com/zdrowiebeztajemnic
(Pelto et al., 1998). L. johnsonii La1 was shown to increase the respiratory burst of hagocytes isolated from human blood following probiotic consumption
Hakansson A, Molin G. Gut microbiota and inflammation. Nutrients. 2011 June; 3(6):637-82.
Ejtahed HS, Mohtadi-Nia J, Homayouni-Rad A, Niafar M, Asghari-Jafarabadi M, Mofid V. Probiotic yogurt improves antioxidant status in type 2 diabetic patients. Nutrition. 2012 May;28(5):539-43.
Oberreuther-Moschner DL, Jahreis G, Rechkemmer G, Pool-Zobel BL. Dietary intervention with the probiotics Lactobacillus acidophilus 145 and Bifidobacterium longum 913 modulates the potential of human faecal water to induce damage in HT29clone19A cells. Br J Nutr. 2004 Jun;91(6):925-32.
Kumar M, Kumar A, Nagpal R, et al. Cancer-preventing attributes of probiotics: an update. Int J Food Sci Nutr. 2010 Aug;61(5):473-96.
de Moreno de LeBlanc A, Matar C, Perdigon G. The application of probiotics in cancer. Br J Nutr.2007 Oct;98 Suppl 1:S105-10.
Kumar M, Kumar A, Nagpal R, et al. Cancer-preventing attributes of probiotics: an update. Int J Food Sci Nutr. 2010 Aug;61(5):473-96.
de Moreno de LeBlanc A, Matar C, Perdigon G. The application of probiotics in cancer. Br J Nutr.2007 Oct;98 Suppl 1:S105-10.
Soltan Dallal MM, Yazdi MH, Holakuyee M, Hassan ZM, Abolhassani M, Mahdavi M. Lactobacillus casei ssp.casei induced Th1 cytokine profile and natural killer cells activity in invasive ductal carcinoma bearing mice. Iran J Allergy Asthma Immunol. 2012 Jun;11(2):183-9.
de Moreno de LeBlanc A, Matar C, Perdigon G. The application of probiotics in cancer. Br J Nutr.2007 Oct;98 Suppl 1:S105-10.
Magrone T, Jirillo E. The interplay between the gut immune system and microbiota in health and disease: nutraceutical intervention for restoring intestinal homeostasis. Curr Pharm Des. 2013;19(7):1329-42.
Sivieri K, Villarreal ML, Adorno MA, Sakamoto IK, Saad SM, Rossi EA. Lactobacillus acidophilus CRL 1014 improved “gut health” in the SHIME(R) reactor. BMC Gastroenterol. 2013 Jun 11;13(1):100.
Kaur IP, Kuhad A, Garg A, Chopra K. Probiotics: delineation of prophylactic and therapeutic benefits. J Med Food. 2009 Apr;12(2):219-35.
Ouwehand AC, Tiihonen K, Saarinen M, Putaala H, Rautonen N. Influence of a combination ofLactobacillus acidophilus NCFM and lactitol on healthy elderly: intestinal and immune parameters. Br J Nutr. 2009 Feb;101(3):367-75.
Buzas GM. Probiotics in gastroenterology — from a different angle. Orv Hetil. 2013 Feb 24;154(8):294-304.
Kondo J, Xiao JZ, Shirahata A, et al. Modulatory effects of Bifidobacterium longum BB536 on defecation in elderly patients receiving enteral feeding. World J Gastroenterol. 2013 Apr 14;19(14):2162-70.
Buzas GM. Probiotics in gastroenterology — from a different angle. Orv Hetil. 2013 Feb 24;154(8):294-304.
Guyonnet D, Schlumberger A, Mhamdi L, Jakob S, Chassany O. Fermented milk containingBifidobacterium lactis DN-173 010 improves gastrointestinal well-being and digestive symptoms in women reporting minor digestive symptoms: a randomised, double-blind, parallel, controlled study. Br J Nutr. 2009 Dec;102(11):1654-62.
Ringel-Kulka T, Palsson OS, Maier D, et al. Probiotic bacteria Lactobacillus acidophilus NCFM andBifidobacterium lactis Bi-07 versus placebo for the symptoms of bloating in patients with functional bowel disorders: a double-blind study. J Clin Gastroenterol. 2011 Jul;45(6):518-25.
Bixquert Jiménez M. Treatment of irritable bowel syndrome with probiotics. An etiopathogenic approach at last? Rev Esp Enferm Dig. 2009 Aug;101(8):553-64.
Ejtahed HS, Mohtadi-Nia J, Homayouni-Rad A, Niafar M, Asghari-Jafarabadi M, Mofid V. Probiotic yogurt improves antioxidant status in type 2 diabetic patients. Nutrition. 2012 May;28(5):539-43.
Kadooka Y, Sato M, Imaizumi K, et al. Regulation of abdominal adiposity by probiotics (Lactobacillus gasseri SBT2055) in adults with obese tendencies in a randomized controlled trial.Eur J Clin Nutr. 2010 Jun;64(6):636-43.
Park DY, Ahn YT, Park SH, et al. Supplementation of Lactobacillus curvatus HY7601 andLactobacillus plantarum KY1032 in diet-induced obese mice is associated with gut microbial changes and reduction in obesity. PLoS One. 2013;8(3):e59470.
Yoo SR, Kim YJ, Park DY, et al. Probiotics L. plantarum and L. curvatus in combination alter hepatic lipid metabolism and suppress diet-induced obesity. Obesity (Silver Spring). 2013 Mar 20.
Luoto R, Kalliomaki M, Laitinen K, Isolauri E. The impact of perinatal probiotic intervention on the development of overweight and obesity: follow-up study from birth to 10 years. Int J Obes(Lond). 2010 Oct;34(10):1531-7.
Ilmonen J, Isolauri E, Poussa T, Laitinen K. Impact of dietary counselling and probiotic intervention on maternal anthropometric measurements during and after pregnancy: a randomized placebo-controlled trial. Clin Nutr. 2011 Apr;30(2):156-64.
Moroti C, Souza Magri LF, de Rezende Costa M, Cavallini DC, Sivieri K. Effect of the consumption of a new symbiotic shake on glycemia and cholesterol levels in elderly people with type 2 diabetes mellitus. Lipids Health Dis. 2012;11:29.
Tomaro-Duchesneau C, Saha S, Malhotra M, et al. Effect of orally administered L. fermentum NCIMB 5221 on markers of metabolic syndrome: an in vivo analysis using ZDF rats. Appl Microbiol Biotechnol. 2013 Oct 13.
Ejtahed HS, Mohtadi-Nia J, Homayouni-Rad A, et al. Effect of probiotic yogurt containingLactobacillus acidophilus and Bifidobacterium lactis on lipid profile in individuals with type 2 diabetes mellitus. J Dairy Sci. 2011 Jul;94(7):3288-94.
Kumar M, Nagpal R, Kumar R, et al. Cholesterol-lowering probiotics as potential biotherapeutics for metabolic diseases. Exp Diabetes Res. 2012;2012:902917.
Mencarelli A, Cipriani S, Renga B, et al. VSL#3 resets insulin signaling and protects against NASH and atherosclerosis in a model of genetic dyslipidemia and intestinal inflammation. PLoS One.2012;7(9):e45425.
Yoon HS, Ju JH, Kim HN, et al. Reduction in cholesterol absorption in Caco-2 cells through the down-regulation of Niemann-Pick C1-like 1 by the putative probiotic strains Lactobacillus rhamnosus BFE5264 and Lactobacillus plantarum NR74 from fermented foods. Int J Food Sci Nutr.2013 Feb;64(1):44-52.
Mencarelli A, Cipriani S, Renga B, et al. VSL#3 resets insulin signaling and protects against NASH and atherosclerosis in a model of genetic dyslipidemia and intestinal inflammation. PLoS One.2012;7(9):e45425.
Mohania D, Kansal VK, Shah D, et al. Therapeutic effect of probiotic dahi on plasma, aortic, and hepatic lipid profile of hypercholesterolemic rats. J Cardiovasc Pharmacol Ther. 2013 May 12.
Cavallini DC, Suzuki JY, Abdalla DS, et al. Influence of a probiotic soy product on fecal microbiota and its association with cardiovascular risk factors in an animal model. Lipids Health Dis.2011;10:126.
Stein K, Borowicki A, Scharlau D, et al. Effects of synbiotic fermentation products on primary chemoprevention in human colon cells. J Nutr Biochem. 2012 Jul;23(7):777-84.
Oberreuther-Moschner DL, Jahreis G, Rechkemmer G, Pool-Zobel BL. Dietary intervention with the probiotics Lactobacillus acidophilus 145 and Bifidobacterium longum 913 modulates the potential of human faecal water to induce damage in HT29clone19A cells. Br J Nutr. 2004 Jun;91(6):925-32.
Stein K, Borowicki A, Scharlau D, et al. Effects of synbiotic fermentation products on primary chemoprevention in human colon cells. J Nutr Biochem. 2012 Jul;23(7):777-84.
Verma A, Shukla G. Probiotics Lactobacillus rhamnosus GG, Lactobacillus acidophilus suppresses DMH-induced procarcinogenic fecal enzymes and preneoplastic aberrant crypt foci in early colon carcinogenesis in Sprague Dawley rats. Nutr Cancer. 2013;65(1):84-91.
Rafter J, Bennett M, Caderni G, et al. Dietary synbiotics reduce cancer risk factors in polypectomized and colon cancer patients. Am J Clin Nutr. 2007 Feb;85(2):488-96.
Leyer GJ, Li S, Mubasher ME, Reifer C, Ouwehand AC. Probiotic effects on cold and influenza-like symptom incidence and duration in children. Pediatrics. 2009 Aug;124(2):e172-9.
Rerksuppaphol S, Rerksuppaphol L. Randomized controlled trial of probiotics to reduce common cold in schoolchildren. Pediatr Int. 2012 Oct;54(5):682-7.
Gluck U, Gebbers JO. Ingested probiotics reduce nasal colonization with pathogenic bacteria (Staphylococcus aureus, Streptococcus pneumoniae, and beta-hemolytic streptococci). Am J Clin Nutr. 2003 Feb;77(2):517-20.
Hamilton EJ, Martin N, Makepeace A, Sillars BA, Davis WA, Davis TM. Incidence and predictors of hospitalization for bacterial infection in community-based patients with type 2 diabetes: the fremantle diabetes study. PLoS One. 2013;8(3):e60502.
Weiskopf D, Weinberger B, Grubeck-Loebenstein B. The aging of the immune system. Transpl Int. 2009 Nov;22(11):1041-50.
Available at: lung.org/lung-disease/pneumonia/understanding-pneumonia.html. Accessed October 17, 2013.
Million M, Lagier JC, Yahav D, Paul M. Gut bacterial microbiota and obesity. Clin Microbiol Infect.2013 Apr;19(4):305-13.
Van den Abbeele P, Verstraete W, El Aidy S, Geirnaert A, Van de Wiele T. Prebiotics, faecal transplants and microbial network units to stimulate biodiversity of the human gut microbiome. Microb Biotechnol. 2013 Jul;6(4):335-40.
Turnbaugh PJ, Ridaura VK, Faith JJ, Rey FE, Knight R, Gordon JI. The effect of diet on the human gut microbiome: a metagenomic analysis in humanized gnotobiotic mice. Sci Transl Med. 2009 Nov 11;1(6):6ra14.
Million M, Lagier JC, Yahav D, Paul M. Gut bacterial microbiota and obesity. Clin Microbiol Infect.2013 Apr;19(4):305-13.
Bengmark S. Nutrition of the critically ill—A 21st-century perspective. Nutrients. 2013 January; 5(1):162-207.
Iapichino G, Callegari ML, Marzorati S, Cigada M, Corbella D, Ferrari S, Morelli L. Impact of antibiotics on the gut microbiota of critically ill patients. J Med Microbiol. 2008;57:1007-14.
Bengmark S. Nutrition of the critically ill—A 21st-century perspective. Nutrients. 2013 January; 5(1):162-207.
British Journal of Nutrition (2011)Michae ¨l Messaoudi1*, Robert Lalonde2, Nicolas Violle1, Herve ´ Javelot3, Didier Desor4, Amine Nejdi1, Jean-Franc ¸ois Bisson1, Catherine Rougeot5, Matthieu Pichelin6, Murielle Cazaubiel6 and Jean-Marc Cazaubiel6: “Assessment of psychotropic-like properties of a probiotic formulation (Lactobacillus helveticus R0052 and Bifidobacterium longum R0175) in rats and human subjects”
onlinelibrary.wiley.com/doi/10.1111/j.1365-2982.2011.01796.x/abstract?deniedAccessCustomisedMessage=&userIsAuthenticated=false
(Korzenik and Podolsky, 2006; Strober et al., 2002 )
horizonpress.com/cimb/v/v10/37.pdf
ncbi.nlm.nih.gov/pmc/articles/PMC4449865/
europepmc.org/abstract/MED/12776000/reload=0;jsessionid=gaKDYzQTJeMIFlasebaS.4
journals.lww.com/jcge/Abstract/2005/05003/Nerves,_Reflexes,_and_the_Enteric_Nervous_System_.2.aspx
ncbi.nlm.nih.gov/pubmed/7743145
ncbi.nlm.nih.gov/pubmed/15765388
ncbi.nlm.nih.gov/pubmed/22136422
ncbi.nlm.nih.gov/pubmed/21988661
onlinelibrary.wiley.com/doi/10.1002/1097-0185%2820010101%29262:1%3C79::AID-AR1013%3E3.0.CO;2-K/full
journals.lww.com/co-gastroenterology/Abstract/1999/07000/Pathogenesis_of_inflammatory_bowel_disease.3.aspx
ncbi.nlm.nih.gov/pubmed/19235895
sciencedirect.com/science/article/pii/S0165032712001371
plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0001308
sciencedirect.com/science/article/pii/S0091674904020810
nature.com/ajg/journal/v101/n7/abs/ajg2006294a.html
ncbi.nlm.nih.gov/pubmed/15765388
ncbi.nlm.nih.gov/pubmed/12117257
ncbi.nlm.nih.gov/pubmed/22811591
ncbi.nlm.nih.gov/pubmed/19703242
ncbi.nlm.nih.gov/pubmed/17395175
ncbi.nlm.nih.gov/pubmed/25517879
ncbi.nlm.nih.gov/pubmed/21365446
ncbi.nlm.nih.gov/pubmed/24257436
ncbi.nlm.nih.gov/pubmed/24735374
ncbi.nlm.nih.gov/pubmed/22548208
ncbi.nlm.nih.gov/pubmed/17359385
ncbi.nlm.nih.gov/pubmed/25518825
ncbi.nlm.nih.gov/pubmed/24987799
ncbi.nlm.nih.gov/pubmed/23618528
ncbi.nlm.nih.gov/pubmed/22093263
ncbi.nlm.nih.gov/pubmed/24475018
ncbi.nlm.nih.gov/pubmed/25331262
ncbi.nlm.nih.gov/pubmed/24556493
ncbi.nlm.nih.gov/pubmed/20659698
ncbi.nlm.nih.gov/pubmed/25178882
ncbi.nlm.nih.gov/pubmed/18727656
ncbi.nlm.nih.gov/pubmed/19453574
ncbi.nlm.nih.gov/pubmed/9820379
ncbi.nlm.nih.gov/pubmed/18263567
ncbi.nlm.nih.gov/pubmed/19528183
ncbi.nlm.nih.gov/pubmed/22610429
ncbi.nlm.nih.gov/pubmed/23122647
ncbi.nlm.nih.gov/pubmed/25291127
ncbi.nlm.nih.gov/pubmed/22230409
ncbi.nlm.nih.gov/pubmed/25291124
ncbi.nlm.nih.gov/pubmed/21895621
Dugas B, Mecenier A, Lenoir-Wijnkoop I i wsp. Immunity and probiotics. Immunology Today 1999, 20: 387-389.
Isolauri E, Sutas Y, Kankaanpaa P i wsp. Probiotics: Effect on immunity. Clinical Nutrition 2001, 73: 444-449.
Nagler-Anderson C. Man the barrier! Strategic defences in the intestinal mucosa. Nature Reviews/Immunology 2001, 1: 59-67.
Brantzaeg P. Current understanding of gastrointestinal immunoregulation and its relation to food allergy. Ann. N.Y. Acad. Sci. 2002, 964: 13-4.
Kopp-Hoolihan L. Prophylactic and therapeutic uses of probiotics: a review. Diet Assoc. 2001, 101: 229-238.
Gill HS, Rutherfurd K J, Prasad J, Gopal PK. Enhancement of natural and acquired immunity by Lactobacillus rhamnosus (HN001), Lactobacillus acidophilus (HN017) and Bifidobacterium lactis (HN019). Br.J.Nut. 2000, 83: 167-176.
Arunachalam K, Gill HS, Chandra RK. Enhancement of immune function by dietary consumption of Bifidobacterium lactis (HN019). Eur. J. Clin. Nutr. 2000, 54: 263-267.
Chiang BL, Sheich YH, Wang LH i wsp. Enhancing immunity by dietary consumption of a probiotic lactic acid bacterium (Bifidobacterium lactis HN019): optimization and definition of cellular immune responses. Eur.J.Clin.Nutr. 2000, 54: 848-855.
Gill HS, Rutherfurd K, Cross ML, Gopal PK. Enhancement of immunity in the elderly by dietary supplementation with the probiotic Bifidobacterium lactis HN019. Am.J.Nutr.2001, 74: 833-839.
Gill HS, Rutherfurd K. Immune enhancement conferred by oral delivery of Lactobacillus Rhamnosus HN001 in different milk-based substrates. J.Dairy.Res. 2001, 68: 611-616.
Miettinen M, Matakainen S, Vuopio-Varkila J i wsp. Lactobacilli and streptococci induce interleukin-12 (IL-12), IL-18 and gamma interferon production in human peripheral blood mononuclear cells. Infection Immunity, 1998, 66:6058-6062.
Miettinen M, Vuopio-Varkila J, Varkila K. Production of human tumour necrosis factor alfa, interleukin-6, and IL-10 is induced by lactic acid bacteria. Infection Immunity 1996, 64: 5403-5405.
Haller D, Blum S, Bode C i wsp. Activation of human peripheral blood mononuclear cells by non-pathogenic bacteria in vitro: evidence of NK cells as primary targets. Infection Immunity 2000, 68: 752-759.
Michałkiewicz J, Krotkiewski M, Gackowska L i wsp. Target cell for immunomodulating effect of lactic acid bacteria. Microb. Ecol. Health. Dis. 2003, in press.
Michałkiewicz J, Krotkiewski M, Gackowska L i wsp. Interaction and synergism of lactic acid bacteria necessary for the balance between the proinflammatory and immunological defence enhancing effects of probiotics. Microb. Ecol. Health. Dis. 2003, submitted.
Maasen CMB, van Holten-Neelen C, Balk F i wsp. Strain-dependent induction of cytokine profiles in the gut by orally administered Lactobacillus strains. Vaccine, 2000, 18: 2613-2623.
Strobel S, Mowat A. Immune responses to dietary antigens: oral tolerance. Immunology Today 1998, 19: 173-180.
Wold AE. Immune effects of probiotics. Scand.J.Nutr. 2001, 45: 76-85.
Bradtzaeg P, Baekkevold ES, Farstad IN i wsp. Regional specialization in the mucosal immune system: what happens In the microcompartments? Immunology Today 1999, 20: 141-151.
Health and nutritional properties of probiotics in food including milk with live lactic acid bacteria,
Raport of a Joint FAO/WHO Expert Consultation. Cordoba, Argentina, 2001.
Shi Y, Chen L, Tong J, Xu C. Preliminary characterization of vaginal microbiota in healthy Chinese
women using cultivation-independent methods. J Obstet Gynaecol Res. 2009;35(3):525-32.
Vásquez A, Jakobsson T, Ahrné S, Forsum U, Molin G. Vaginal lactobacillus flora of healthy Swedish
women. J Clin Microbiol. 2002;40(8):2746-9.
Zhou X, Brown CJ, Abdo Z, Davis CC, Hansmann MA, Joyce P, Foster JA, Forney LJ. Differences
in the composition of vaginal microbial communities found in healthy Caucasian and black women.
ISME J. 2007;1(2):121-33.
Zhou X, Hansmann MA, Davis CC, Suzuki H, Brown CJ, Schütte U, Pierson JD, Forney LJ. The
vaginal bacterial communities of Japanese women resemble those of women in other racial groups.
FEMS Immunol Med Microbiol. 2010; 58(2):169-81.
Garg KB, Ganguli I, Das R, Talwar GP. Spectrum of Lactobacillus species present in healthy vagina
of Indian women. Indian J Med Res. 2009; 129(6):652-7.
Strus M, Brzychczy-Włoch M, Kucharska A, Gosiewski T, Heczko PB. Działanie in vitro bakterii
z rodzaju Lactobacillus izolowanych z pochwy na grzyby wywołujące kandydozę sromu i pochwy.
Med Dooew Mikrobiol. 2005; 55: 7-17.
Heczko P. Sprawozdanie z badań laboratoryjnych właściwości probiotycznych szczepów probiotycznych
bakterii z rodzaju Lactobacillus wykonanych w Katedrze Mikrobiologii Collegium Medicum
UJ. 2004
Strus M. Sprawozdanie z badań dotyczących zjawiska adherencji wybranych szczepów do ludzkich
linii tkankowych HT-29 MTX i Caco-2. 2010
Strus M, Kochan P, Chełmicki Z, Chełmicki A, Stefański G, Dechnik K, Jabłońska E, Heczko P.
Wpływ doustnego podawania trzech probiotycznych szczepów Lactobacillus na poprawę odczynu
i składu mikroflory pochwy u kobiet w wieku reprodukcyjnym. Gin. Dypl. 2008; 3: 53-59.
Heczko P. Sprawozdanie z badań laboratoryjnych nad właściwościami probiotycznymi szczepów
bakterii z rodzaju Lactobacillus w preparacie prOVag firmy IBSS BIOMED S.A. w Krakowie. 2006
Heczko P. Ocena skuteczności kolonizacji dróg rodnych i odbytu w trakcie stosowania preparatu
pro biotycznego prOVag. 2007
Osset J, Bartolomé RM, García E, Andreu A. Assessment of the capacity of Lactobacillus to
inhibit the growth of uropathogens and block their adhesion to vaginal epithelial cells. J Infect Dis.
2001;183(3):485-91.
Strus M. Sprawozdanie z badań dotyczących zdolności do hamowania adhezji patogenów do
powierzchni komórek nabłonka pochwy przez szczepy probiotyczne: Lactobacillus fermentum 57A,
Lactobacillus plantarum 57B, Lactobacillus gasseri 57C oraz ich mieszaninę. 2010
Ocana VS, de Ruiz Holgado AA, Nader-Macías ME. Growth inhibition of Staphylococcus aureus
by H2O2-producing Lactobacillus paracasei subsp. paracasei isolated from the human vagina.
FEMS Immunol Med Microbiol. 1999;23(2):87-92
Strus M, Brzychczy-Włoch M, Kochan P, Heczko P. Nadtlenek wodoru w regulacji mikroflory
pochwy. Med Dosw Mikrobiol. 2004;56(1):67-77.
Strus M. Sprawozdanie z badania zdolności produkcji przez szczepy probiotyczne enzymów
antyoksydacyjnych o charakterze przeciwzapalnym. 2010.
Guidelines for the Evaluation of Probiotics in Food. Report of a joint FAO/WHO Working Group
on Drafting Guidelines for the Evaluation of Probiotics in Food. 2002
Strus M. Badanie hamującego działania nonoksynolu-9 na wybrane szczepy Lactobacillus fermentum
57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C w czasie 5 i 24 godzin. 2008
Strus M. Sprawozdanie z badań nad opornością bakterii probiotycznych na leki przeciwdrobnoustrojowe.
2010.
(Haller et al., 2000).
(Schiffrin et al., 1997)(Arunachalam et al., 2000)
(Pelto et al., 1998)
(Gill et al., 2001a; Sheih et al., 2001)
(Ogawa et al., 2006)
(Takeda et al., 2006)
(Donnet-Hughes et al., 1999)
(Lammers et al., 2002; Otte and Podolsky, 2004)
(Zhang et al., 2005)
(Ma et al., 2004)
(Ruiz et al., 2005)
(Vinderola et al., 2005)
(Ogawa et al., 2006)
(Isolauri et al., 1995)
(Pochard et al., 2002)
(Shida et al., 2002)
(Pohjavuori et al., 2004)
(Sutas et al., 1996a)
(Arunachalam et al., 2000; Kishi et al., 1996)
(Miettinen et al., 1998)
(Perdigon et al., 2002)
(Pessi et al., 2000)
(Kuhn et al., 1993)
(Madsen et al., 1999)
(Sheil et al., 2004)
(Pena et al., 2005)
https://pl.wikipedia.org/wiki/Immunoglobuliny_A