Glutation cz.1 – skutki niedoborow i powiazania z roznymi chorobami

Glutation czesto nazywany jest 'krolem antyoksydantow’, produkowany i wykorzystywany przez kazda komorke ludzkiego ciala przez co ma szeroki zakres wlasciwosci zdrowotnych. Suplementujac glutation trzeba zwrocic uwage na forme suplementu – najwyzsza wchlajalnoscia cechuja sie formy liposomalne i takowe tez polecam.
Glutation jest peptydem skladajacym sie z aminokwasow. Wg.naukowcow, moze byc on dobrym wskaznikiem sredniej dlugosci zycia. Tak jak witamina C czy E, glutation jest waznym antyoksydantem – poprzez usuwanie wolnych rodnikow, chroni rozne uklady organizmu przed chrobami i ich dysfunkcja. Pelni on rowniez funkcje ochronna przed ksenobiotykami (lekami, zanieczyszczeniami, kancerogenami).
Jego niedobor przejawia sie zwiekszona podatnoscia na stres oksydacyjny, co przeklada sie na choroby takie jak rak, choroba Parkinsona czy Alzheimera, stad tez regulacja jego metabolizmu jest kluczowa w celu zapewnienia sobie optymalnego zdrowia. Jakie jeszcze pelni funkcje i przed czym moze ochronic?
- Wiele chorob ukladu oddechowego spowodowane jest nadmiernym stanem zapalny. W wielu z tych chorob, przywracajac glutation do prawidlowego poziomu wspiera sie walke organizmu ze stanami zapalnymi takowych ukladow.
- Kilka badan wykazuje jego role w przedluzaniu zycia (poprzez walke z wolnymi rodnikami) oraz regulacje ukladu odpornosciowego (co tez ma wplyw na dlugosc zycia). Sa takze badania ktore wykazuja, ze wraz z wiekiem poziomy glutationu w organizmie sukcesywnie sie obnizaja.
- Choroby watroby wywolane sa przez stres oksydacyjny. Glutation moze utrzymac watrobe w dobrej kondycji poprzez redukcje tego stresu. Pelni on takze wazna role w detoksykacji watroby kontrolujac poziom tioli/dwusiarczkow w komorkach. Wykazano rowniez, ze watroba podwyzsza poziom syntezy glutationu w odpowiedzi na diete wysokotluszczowa.
- Doustne podawanie zredukowanego glutationu(300mg/dzien) jest skuteczne w przypadku niealkoholowego stluczenia watroby, ktore ostatecznie moze prowadzic do nowotworu watroby.
- Spozywanie takich uzywek jak metamfetamina, alkohol czy kokaina prowadzi do wzmozonej produkcji wolnych rodnikow. Moga one zmieniac bialka zaangazowane w szlaki neuronalne oraz kognitywne, powodujac zaostrzenie sie nalogu. Poprzez zmniejszenie reaktywnych form tlenu(ROS – wolnych rodnikow) glutation moze zmniejszyc problem uzaleznienia i efektow ubocznych w/w substancji.
- Niedobor glutationu powoduje stan zapalny drog oddechowych u myszy. Zapalenie zmniejszylo sie, kiedy myszom podano glutation.
- Hamuje zapalny czynnik transkrypcyjny NF-kappaB(jego nadmierna aktywnosc skraca zycie,zwieksza stany zapalne i przyczynia sie do dziesiatek chorob, ktore sa powiazane ze stanami zapalnymi)
- Poziom glutationu spada podczas menopauzy,co jest tez przyczyna starzenia sie.
- Poprzez utrzymanie optymalnych poziomow glutationu, mozna uniknac pogorszenia sie funkcji kognitywnych z wiekiem.
- Jedno z badan sugeruje, ze obnizenie sie poziomow glutationow (z wiekiem) ze wzgledu na stres oksydacyjny, moze prowadzic do zwiekszonej lamliwosci kosci oraz osteoporozy.
- Jedno z badan sugeruje, ze Myricitrin, lek stosowany w zapobieganiu osteoporozie, moze dzialac poprzez zwiekszanie poziomu glutationu.Inne z badan wykazalo, ze lek o nazwie Alprazolam, uzywany do lagodzenia stresu, podwyzsza poziomy glutationu u myszy.
- Badania wykazaly, ze glutation moze rozjasnic skore u zdrowych kobiet. Dzieje sie tak, poniewaz powoduje on produkcje innego typu melaniny w komorkach skory.
- Glutation moze byc podawany doustnie, pod jezyk, poprzez inhalacje lub dozylnie a jego podawanie z witamina C moze dodatkowo zwiekszyc jego absorbcje. Nalezy zwrocic uwage ze ludzie z astma nie powinni otrzymywac glutationu w postaci wziewnej/inhalacji tak samo nie poleca sie podawania suplementow z glutationem matka w ciazy i karmiacych piersia.
- Wykazano, ze u ludzi z depresja, wystepuja niskie poziomy glutationu.
- Komorki ludzkiego mozgu zuzywaja ok.20% tlenu wykorzystywanego przez organizm, lecz stanowia jedynie 2 procent wagi ciala. Wolne rodniki sa natomiast caly czas produkowane podczas metabolizmu. W zwiazku z tym, detoks z wolnych rodnikow jest bardzo waznym zadaniem dla mozgu w ktorym glutation pelni kluczowa role.
- Choroba Alzheimera jest po czesci spowodowana przez stres oksydacyjny. W badaniach klinicznych zademonstrowano, ze doustne podawanie witaminy E spowolnilo postep choroby.
- Dodatkowo, w Alzheimerze nastepuje charakterystyczna akumulacja bialka wiazacego DNA(TDP-43) w ukladzie nerwowym, ktore obniza poziomy glutationu.
- Choroba Parkinsona, po czesci jest spowodowana wysokim stresem oksydacyjnym w ukladzie nerwowym. Glutation naturalnie w tym przypadku moze pomoc. W w/w chorobie dochodzi do smierci neuronow dopaminergicznych w istocie czarnej mozgu. Inne badanie potwierdzilo, ze ludzie w fazie przedklinicznej tej chrooby, maja niskie poziomy glutationu.
- Kolejne badanie wykazalo, ze lek 3,4-dihydroxybenzalacetone, pomogl zapobiec chorobie Parkinsona poprzez zwiekszenie poziomow glutationu.
- Choroba Huntingtona jest spowodowana przez stres oksydacyjny i dysfunkcje mitochondriow. Badania pokazaly, ze pewna forma kurkuminy pomogla poprawic kondycje mitochondriow poprzez zwiekszenie poziomu glutationu.
- Infekcje wirusowe powoduja duze ilosci stresu oksydacyjnego w komorkach poprzez zwiekszenie stanow zapalnych i obnizenie poziomu glutationu. W wielu chorobach(AIDS, gruzlica, mukowiscydoza, grypa czy alkoholizm) obnizona odpornosc i zwiekszone ryzyko infekcji jest bezposrednio powiazane z niskimi poziomami glutationu.
- Ubytek glutationu obniza aktywnosc makrofagow(funkcja przeciwinfekcyjna) lecz wykazano, ze n-acetylcysteina(NAC) zwieksza wewnatrzkomorkowa walke z infekcjami(poprzez zwiekszenie poziomu glutationu).
- Inne badanie pokazalo, ze utrzymanie prawidlowego poziomu cysteiny, a tym samym i glutationu jest niezbedne w celu zwiekszenia aktywnosci obrony przeciwbakteryjnej organizmu.
- U ludzi z syndromem jelita drazliwego IBS wykryto zmniejszone aktywnosci enzymow uczestniczacych w syntezie glutationu oraz nizskie poziomy prekursora glutationu – cysteiny.
- Peroksydaza glutationowa jest waznym enzymem dla normalnego funkcjonowania sciany jelita a sam glutation chroni blone sluzowa jelit. Podawanie glutationu moze zatem chronic sciane jelit, gdy jest ona oslabiona(i wystepuje np. syndrom przeciekajacego jelita).
- Dzieci ze zdiagnozowanym Autyzmem maja nizsze(o 20-40%) poziomy glutationu niz ich rowiesnicy. Stwierdzono tez u nich nizsze poziomy cysteiny.
- Jest glownym czynnikiem regulacji zycia, podzialu i smierci komorek nowotworowych
- Jego niedobory, lub spadek stosunku glutation/dwusiarczek glutationu(GSSG) prowadzi do zwiekszonego stresu oksydacyjnego zaangazowanego w rozwoj nowotworow.
- Istnieje bezposredni zwiazek pomiedzy zwiekszonym spozyciem glutationu, a obnizonym ryzykiem zapadalnosci na raka jamy ustnej i gardla.
- Odgrywa wazna role w naprawie szkod wyrzadzonych przez leki antynowotworowe na zdrowych komorkach u pacjentow po chemioterapi.
- Odgrywa kluczowa role w usuwaniu i detoksycakcji kancerogenow. Wazny jest odpowiedni balans,gdyz pewne badania sugeruja, ze za wysokie poziomy glutationu moga ochraniac komorki nowotworowe.
- Schizofrenicy maja niskie poziomy Glutationu. N-acetyl-cysteina zwieksza poziomy glutationu we krwi i udowodniono, ze poprawia stan ludzi z ta choroba.
- U ludzi z zaburzeniami obsesyjno-kompulsywnymi wystepuja niskie poziomy glutationu w niektorych czesciach mozgu (np.zakretu obreczy kory mozgowej). Wysokie poziomy wolnych rodnikow wykryto w krwi pacjentow z w/w choroba. Zmniejszeni ich poziomu poprzez podanie glutationu moze zmniejszyc nasilenie objawow choroby.
- Moze pomoc zmniejszyc stres, ktory jest glownym objawem i czynnikiem potencjalnie przyczyniajacym sie do objawow obsesyjno-kompulsywnych.
- Wiele lekow stosowanych w leczeniu zaburzen choroby dwubiegunowej dziala na zasadzie zwiekszania poziomu glutationu w organizmie.
- Wykazano, ze pacjenci z ADHD maja niskie poziomy glutationu oraz wysokie poziomy stresu oksydacyjnego. Pycnogenol, ktory zwieksza poziom glutationu, normalizuje takze poziomy przeciwutleniaczy u osob z ta choroba.
- Niski poziom peroksydazy glutationowej oraz niski poziom systemowego i kardiologicznego glutationu jest powiazany ze zwiekszonym ryzykiem wystapienia zawalu serca.
- Choroby sercowo-naczyniowe sa glownie spowodowane przez stres oksydacyjny w tkankach serca. Stad tez opornosc na insuline, nietolerancja glukozy i cukrzyca(wszystkie 3 stany powoduja stres oksydacyjny) sa bezposrednio zwiazane z zawalami serca. Glutation moze pomoc w zmniejszeniu wolnych rodnikow,a to ogranicza ryzyko wystapienia udaru mozgu i zawalu serca.
- Redukujac nadmierna ilosc wolnych rodnikow i zmniejszajac stres oksydacyjnych chroni przed uszkodzeniami komorek, DNA czy neurodegeneracja(co tez jest zreszta uszkodzeniem komorek) oraz wydluza zycie.
- Pelni funkcje regeneratora antyoksydantow takich jak witamina C i E.
- Hamuje wytwarzanie cytokin zapalnych(powodujacych stany zapalne w organizmie)
- Wg.badan osoby z cukrzyca typu 2 z wysokim poziomem cukru we krwi musza sie liczyc z obnizonymi poziomami glutiationu w swoim organizmie. Wykazano, ze akumulacja wolnych rodnikow, powoduje wiele komplikacji zwiazanych z cukrzyca typu 2 takich jak zaburzenia sercowo-naczyniowe oraz neurodegeneracje. Udowodniono, ze podawanie glutationu moze ograniczyc w/w powiklania.
- Stres oksydacyjny w nerkach moze spowodowac ich niewydolnosc. Badania na szczurach pokazaly, ze prekursor glutationu – NAC(n-acetyl-cysteina), moze zapobiegac chorobom nerek.
- W jednym z badan, w ktorym oceniono dwusdziestu pacjentow cierpiacych na przewlekla niewydolnosc nerek i poddawanych hemodializie, okazalo sie, ze uzupelniajac u nich glutation, spowodowal on wyrazna poprawe czynnosci nerek (stwierdzono to po zbadaniu czerwonych krwinek, poziomu glutationu w osoczu, hematokrytu i hemoglobiny).
- Omawiana substancja polepsza rowniez funkcje watroby u alkoholikow, jednak tylko w przypadku calkowitego odstawienia alkoholu. Zmniejsza ona poziom alkoholu we krwi, acetyl aldehydu oraz poziom trojglicerydow.
- Chroniczne spozywanie alkoholu wzmaga stres oksydacyjny w plucach, ktory czesto prowadzi do zakazen drog oddechowych oraz zapalenia pluc. Glutation chroni pluca poprzez zmniejszenie stresu oksydacyjnego.
- Ubytek glutationu jest kluczowy sygnalem kontrolujacym szlak smierci komorki. Np. s-glutationylacja jest wazna dla tworzenia sie i smierci bialek. Komorki wyczerpane z glutationu podatne sa na uszkodzenia(zwlaszcza kwasu arachidonowego). Badania wykazaly, ze niskie poziomy glutationu spowodowac moga serie zdarzen, prowadzaca do smierci komorek. Jedno z badan wykazalo, ze niskie poziomy omawianej substancji, zwieksza poziomy stanow zapalnych i powoduje astme.
- To samo badanie wykazalo, ze zwiekszajac poziom glutationu zmniejszono stany zapalne oraz sama astme.
- Przewlekla obtrukcyjna choroba pluc jest choroba spowodowana dlugotrwalym oksydacyjnym uszkodzeniem tkanki plucnej, ktorej uszkodzenie powoduje zapalenie tkanki pluc, powodujac tym samym skrocenie oddechu i kaszel. Suplementy diety z glutationem moga obnizyc poziom stresu oksydacyjnego w tkankach pluc, tym samym przyczyniajac sie do zminimalizowania ryzyka zapadniecia na ta chorobe.
- Pacjenci z bezdechem sennym maja bardzo wysoki poziom stresu oksydacyjnego co w konsekwencji powoduje zubozone poziomy glutationu. Badania pokazaly, ze podwyzszenie tego poziomu poprawilo jakosc snu u w/w osob.
- Wysoki poziom stresu oksydacyjnego prowadzi do niskich poziomow glutationu u pacjentow z tradzikiem. Wysnuto wniosek, ze spadek aktywnosci antyoksydacyjnej, a zwlaszcza zmniejszenie ilosci glutationu moze przyczyniac sie do rozwoju tradziku.
- Badania wykazaly, ze mechanizmy antyoksydacyjne moga byc obnizone u pacjentow z reumatoidalnym zapaleniem stawow – RZS. Poziom glutationu okazal sie u nich znacznie obnizony. Takie osoby maja zwiekszony poziom peroksydazy glutationowej w odpowiedzi na wysoki poziom stresu oksydacyjnego. Suplementacja glutationem powinna pomoc i w tym przypadku.
- Jaskra i zacma stopniowo prowadzi do utraty wzroku. Obydwa te schorzenia spowodowane sa czesciowo przez stres oksydacyjny panujacy w nerwie wzrokowym, ktory moze zmniejszyc glutation.
- U kobiet ciezarnych, niskie poziomy glutationu prowadza do depresji a to moze niekorzystnie wplywac na rozwoj mozgu u dziecka w lonie matki. Zwiekszona ilosc reaktywnych form tlenu w organizmie plodu zwiazana jest z przedwczesnym porodem. Tak wiec, zmniejszenie stresu oksydacyjnego, poprzez zwiekszenie poziomu glutationu jest wazne i w tym przypadku.
- Jedno z badan wykazalo, ze u starszych ludzie z AIDS, mitochondria produkowaly nizsze poziomy glutationu.
- NAC(prekursor glutationu) blokuje funkcje cytokiny zapalnej TNF alfa do stymulacji replikacji wirusa HIV.
- Osoby z AIDS z obnizona iloscia glutationu maja zwiekszona insulinoopornosc oraz sile miesni. Glutation pomaga takze i w tych przypadlosciach.
- Niedobor glutationu pogarsza funkcje ukladu odpornosciowego u chorych z AIDS. Badania pokazaly, ze podawanie glutationu wzmacnia w/w funkcje oraz zmniejsza prawdopodobienstwo zachorowania na gruzlice.
- Wykazano, ze ludzie z mukowiscydoza rowniez maja niskie poziomy glutationu. Mukowiscydoza powoduje uwalnianie wolnych rodnikow powodujac stany zapalne pluc, takze tutaj niezbedne jest wsparcie produkcji tej substancji. Badania pokazaly, ze podawanie glutationu w formie inhalatorow poprawia pojemnosc i funkcje pluc poprzez redukcje stanow zapalnych i zmniejszenie stresu oksydacyjnego.
W jednym z badan 38 pacjentow w wieku 21-62lata otrzymywalo 1 gram glutationu dziennie przez 4 tygodnie. Dzialania nieporzadane byly ograniczone, jednak obejmowaly – zwiekszone wzdecia, luzne stolce(5 pacjentow), zaczerwienienie twarzy(2 pacjentow), przyrost masy ciala(1 osoba) – naturalnie w/w problemy wcale nie musialy byc powiazane bezposrednio z glutationem. Osobiscie bralem 2.5grama w formie dozylnej dziennie(bardzo krotki okres czasu) i niczego negatywnego nie zanotowalem. Bralem rowniez po 300mg przez dlugi okres czasu(w formie podjezykowej) i takze negatywnych skutkow ubocznych nie doswiadczylem.
Najwazniejsze w wytwarzaniu glutationu sa aminokwas glicyna, metionina oraz cysteina jak i rowniez selen, ktory odpowiedzialny jest za utrzymywanie zdrowego poziomu glutationu, gdyz jest on skladnikiem peroksydazy glutationowej, enzymu, ktory neutralizuje wolne rodniki. Osobiscie polecam takze suplementacje ALA, ktory zwieksza poziomy glutationu w komorkach.
Post wydał Ci się wartościowy?a może po prostu mnie lubisz ;)?podziel się nim na Facebooku i go udostępnij!
Polub tego bloga na FB, gdzie znajdziesz też dodatkowe newsy, których tutaj nie publikuje https://www.facebook.com/zdrowiebeztajemnic
Obserwuj mnie na instagramie www.instagram.com/premyslaw84
Głosuj i wybieraj kolejne tematy – prawa strona bloga – zakładka „Ankieta”
ncbi.nlm.nih.gov/pmc/articles/PMC3628138/
ncbi.nlm.nih.gov/pubmed/8001743
ncbi.nlm.nih.gov/pubmed/24835770
medicinenet.com/script/main/art.asp?articlekey=50746
ncbi.nlm.nih.gov/pmc/articles/PMC3664913/
ncbi.nlm.nih.gov/pubmed/19169150
ncbi.nlm.nih.gov/pubmed/14555227
ncbi.nlm.nih.gov/pmc/articles/PMC2756154/
ncbi.nlm.nih.gov/pubmed/12818476
ncbi.nlm.nih.gov/pubmed/14988435
kellersformula.com/glutathione-deficiency/
tandfonline.com/doi/abs/10.1080/10715769900300851
ncbi.nlm.nih.gov/pubmed/19169150
ncbi.nlm.nih.gov/pubmed/19393193
tandfonline.com/doi/abs/10.1080/10715769900300851
ncbi.nlm.nih.gov/pmc/articles/PMC3628138/
ncbi.nlm.nih.gov/pmc/articles/PMC3048347/
ncbi.nlm.nih.gov/pubmed/24978607
ncbi.nlm.nih.gov/pubmed/2065663/
ncbi.nlm.nih.gov/pmc/articles/PMC3048347/
ncbi.nlm.nih.gov/pubmed/26362762
ncbi.nlm.nih.gov/pmc/articles/PMC2756154/
instituteofwomenshealth.com/wp-content/uploads/2013/04/Burdette-Oxidative-Therapy-and-Hormones.pdf
ncbi.nlm.nih.gov/pubmed/21693129
ncbi.nlm.nih.gov/pubmed/25130202
ncbi.nlm.nih.gov/pmc/articles/PMC3964749/#R37
ncbi.nlm.nih.gov/pubmed/21552194
ncbi.nlm.nih.gov/pubmed/7972287
ncbi.nlm.nih.gov/pubmed/17652828
ncbi.nlm.nih.gov/pubmed/10880854
ncbi.nlm.nih.gov/pubmed/24960578
onlinelibrary.wiley.com/store/10.1046/j.1432-1327.2000.01595.x/asset/j.1432-1327.2000.01595.x.pdf;jsessionid=BBD638CC57470129A86D18A6CA32A856.f01t03?v=1&t=iq3l2nh5&s=7f87170e0d01c37b90a9f2fc28e521d5a6a74bda
ncbi.nlm.nih.gov/pubmed/23325230
ncbi.nlm.nih.gov/pubmed/23959789
ncbi.nlm.nih.gov/pubmed/24008671
ncbi.nlm.nih.gov/pubmed/23089304
ncbi.nlm.nih.gov/pubmed/23089304
ncbi.nlm.nih.gov/pmc/articles/PMC3048347/
ncbi.nlm.nih.gov/pubmed/15731094
ncbi.nlm.nih.gov/pubmed/17046819/
gut.bmj.com/content/42/4/485.full
ncbi.nlm.nih.gov/pubmed/17937616/
ncbi.nlm.nih.gov/pubmed/18612812/
ncbi.nlm.nih.gov/pubmed/16917939/
ncbi.nlm.nih.gov/pubmed/15585776/
ncbi.nlm.nih.gov/pmc/articles/PMC3628138/
ncbi.nlm.nih.gov/pubmed/14555227
hindawi.com/journals/omcl/2013/972913/
ncbi.nlm.nih.gov/pmc/articles/PMC3664913/
ncbi.nlm.nih.gov/pubmed/24149024
ncbi.nlm.nih.gov/pubmed/15386533
hindawi.com/journals/omcl/2013/972913/#B10
ncbi.nlm.nih.gov/pubmed/18436195
ncbi.nlm.nih.gov/pubmed/26949749
ncbi.nlm.nih.gov/pmc/articles/PMC3964749/#R37
ncbi.nlm.nih.gov/pubmed/17652828
ncbi.nlm.nih.gov/pubmed/17184924
ncbi.nlm.nih.gov/pubmed/24568073
ncbi.nlm.nih.gov/pubmed/16984739
nejm.org/doi/full/10.1056/NEJMoa030535#t=article
journals.plos.org/plosone/article?id=10.1371/journal.pone.0004871
ncbi.nlm.nih.gov/pubmed/15256685
ncbi.nlm.nih.gov/pubmed/26242742
nhlbi.nih.gov/research/reports/2004-oxidative-stress
conferenciasindromemetabolico.org/wp-content/uploads/2013/02/Is_Oxidative_Stress_the_Pathogenic_Mechanism_Underlying.pdf
sciencedirect.com/science/article/pii/S0085253815487095
ncbi.nlm.nih.gov/pubmed/23089304
ncbi.nlm.nih.gov/pubmed/26461335
ncbi.nlm.nih.gov/pubmed/1501736
ncbi.nlm.nih.gov/pubmed/26694382
ncbi.nlm.nih.gov/pmc/articles/PMC2596047/
ncbi.nlm.nih.gov/pubmed/7342494
businesswire.com/news/home/20160505005229/en/Study-Reveals-Glutathione%E2%80%99s-Role-Combating-Non-Alcoholic-Fatty
researchgate.net/publication/51173133_Cellular_glutathione_in_fatty_liver_in_vitro_models
ncbi.nlm.nih.gov/pmc/articles/PMC4455547/
ncbi.nlm.nih.gov/pubmed/26809999
ncbi.nlm.nih.gov/pubmed/24634252
ncbi.nlm.nih.gov/pmc/articles/PMC4455547/
ncbi.nlm.nih.gov/pubmed/8869667
ncbi.nlm.nih.gov/pubmed/24441868
ncbi.nlm.nih.gov/pubmed/22656858
sciencedirect.com/science/article/pii/S0167488912001760
ncbi.nlm.nih.gov/pubmed/12217624
ncbi.nlm.nih.gov/pubmed/24742380
nlm.nih.gov/medlineplus/copd.html
ncbi.nlm.nih.gov/pubmed/27117852
ncbi.nlm.nih.gov/pubmed/20073373
ncbi.nlm.nih.gov/pubmed/22610662
ncbi.nlm.nih.gov/pubmed/20073373
ncbi.nlm.nih.gov/pubmed/11349462
ncbi.nlm.nih.gov/pmc/articles/PMC3012032/
ncbi.nlm.nih.gov/pubmed/21896138
ncbi.nlm.nih.gov/pubmed/11180282
ncbi.nlm.nih.gov/pubmed/23010849
ncbi.nlm.nih.gov/pubmed/26692723
ncbi.nlm.nih.gov/pubmed/27174401
ncbi.nlm.nih.gov/pubmed/25757563
ncbi.nlm.nih.gov/pubmed/24081740
ncbi.nlm.nih.gov/pubmed/2112750/
ncbi.nlm.nih.gov/pubmed/24081740
ncbi.nlm.nih.gov/pubmed/23409922
ncbi.nlm.nih.gov/pubmed/23409922
ncbi.nlm.nih.gov/pubmed/8125859
ncbi.nlm.nih.gov/pubmed/23089304
ncbi.nlm.nih.gov/pubmed/23089304
ncbi.nlm.nih.gov/pubmed/14726422
ncbi.nlm.nih.gov/pubmed/10409605
sciencedirect.com/science/article/pii/S0012369215324077
ncbi.nlm.nih.gov/pubmed/27088927
ncbi.nlm.nih.gov/pmc/articles/PMC4207440/
ncbi.nlm.nih.gov/pubmed/27088927
webmd.com/vitamins-supplements/ingredientmono-717-glutathione.aspx?activeingredientid=717
ijdvl.com/article.asp?issn=0378-6323;year=2013;volume=79;issue=6;spage=842;epage=846;aulast=Malathi#ref8
ncbi.nlm.nih.gov/pubmed/21875351
ncbi.nlm.nih.gov/pubmed/18499536
webmd.com/vitamins-supplements/ingredientmono-717-glutathione.aspx?activeingredientid=717
Układ odpornościowy cz.4 – Limfocyty Th17 – regulator ukladu immunologicznego – co powoduja?jak je kontrolowac?
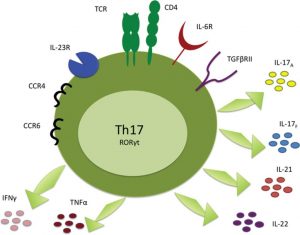
Komorki pomocnie T (T helper) rozpoczynaja 'swoje zycie’ jako komorki Th0, ktore nastepnie przeksztalcaja sie w limfocyty th1, th2 albo Th17. Niedojrzale komorki T moga stac sie komorkami zapalnymi Th17 lub przeciwzapalnymi Treg(T regulacyjne). Osoby, ktorych trapia stany zapalne, beda chcialy, aby Th0 przeksztalcaly sie w Treg, natomiast Ci, ktorzy cierpia na niedobor stanow zapalnych(np. zaawansowana kandydoza) do Th17.
Jedna z cytokin zapalnych, ktora moze przyczynic sie powstawania cytokin zapalnych Th17 jest np. Il-1beta(zwieksza ona poprostu produkcje Th17 zamiast produkcje Treg). Taka sama 'moc’ maja wysokie poziomy cytokiny zapalnej IL-6 oraz TGF-beta.
- Jedno z badan pokazuje, ze IL-17 jest powiazane z odpowiedzia alergiczna, aktywuje wytwarzanie wielu substancji zapalnych takich jak IL-6,IL-1, TGF-beta,TNF alfa, IL-8, MCP-1 i PGE2 w wielu typach komorek. Uwanianie sie w/w czynnikow zapalnych powoduje miedzyinnymi takie problemy jak zwezenie drog oddechowych (co ma miejsce u astmatykow).
- Co ciekawe komorki Th17 maja swoj rytm dobowy (zmienia sie ich aktywnosc w trakcie dnia i nocy). Zwiekszona ich produkcja nastepuje w nocy ok.polnocy, nizsza ok.poludnia.
- Limfocyty Th17 produkuja cytokiny zapalne IL-17 jak i rowniez TNF-alfa.
- IL-17 zwiekszaja kynurenine (tak samo zwieksza ja kortyzol, IL-1, TNF czy tez wysoki interferon gamma czyli cale ramie limfocytow Th1). Kynurenina bez problemow przekracza bariere krew-mozg, moze powodowac drgawki. Dowiedziono ze powoduje stres oksydacyjny na poziomie komorkowym co prowadzi do uszkodzenia komorki. Niskie poziomy tego kwasu sa jak najbardziej ok (przewaznie sprawdza sie stosunek kwasu kynureninowego vs kwas chinolinowy). Jednak bardzo wysokie poziomy kynureniny sa bezposrednio powiazane z chorobami neurodegeneracyjnymi jak np.Alzheimer, choroba Parkinsona, Huntingtona czy udar mózgu oraz chorobami psychicznymi, takimi jak schizofrenia i depresja(wysoki poziom to Alzheimer,schizofrenia, zespol Downa czy IBS, niski poziom choroba Parkinsona). Stwierdzono ponadto, że zwiększenie ilości kwasu kynureninowego w mózgu powoduje zaburzenie procesów uczenia się i uwagi. Ponadto kwas kynureninowy blokuje receptory NMDA, AMPA, glutaminianiu i receptory nikotynowe – stad wlasnie zaburzenia uczenia sie i uwagi. Wyregulowanie tego kwasu (co potwierdzaja badania) pozytywnie wplywa na funkcje kognitywne u osob z chorobami autoimmunologicznymi/neurodegeneratywnymi (wiedza o tym doskonale rodzice autystow kierujac sie chociazby wynikami badania OAT).
Jak juz wczesniej wspomnialem limfocyty Th17 nie zawsze sa zle – negatywnie dzialaja tylko w przypadku ich nadprodukcji/nadaktywnosci. Badania pokazuja ze dobrze radza sobie z infekcjami grzybicznymi(oraz pozakomorkowymi infekcjami bakteryjnymi), a ich niedobor praktycznie nie pozwala na wygrana z grzybica(stad niektore osoby na forum fungidia mecza sie latami z Candida).
- Dowiedziono takze, ze u ludzi z alergiami pokarmowymi, wystepuje slaba produkcja IL-17. Podkresla sie wiec role IL-17 jako potencjalnego markera nietolerancji pokarowych.
- Wykazano takze, ze poziomy IL-17A sa wysokie u ludzi z ciezkim bezdechem sennym natomiast niskie w przypadku lekkiego snu.
Z jakimi chorobami bezposrednio kojarzy sie zwiekszone poziomy limfocytow Th17?
– Zapalenie blony naczyniowej oka
– Cukrzyca typu 1
– Niektore przypadki IBS
– Hashimoto
– choroba Gravesa-Basedowa
– Stwardnienie rozsiane
– Bezdech senny(tutaj tez moze byc odwrotnie – bezdech senny moze powodowac podwyzszenie Th17)
– Niektore przypadki tradziku, luszczycy i egzemy
– Bialaczka, szpiczak mnogi
– Reumatoidalne zapalenie stawow – RZS
– Wspomniana juz wyzej astma
– Stany zapalne drog oddechowych
– Choroba Lesniowskiego-Crohna
– Estradiol hamuje odpowiedz komorkowa Th17.
– Fibromyalgia(ta choroba akurat powoduje wzrost IL-17A)
– Osteoporoza
– Bezplodnosc u kobiet (nadreaktywny uklad odpornosciowy moze atakowac plemniki)
– Chroniczna borelioza zwieksza cytokiny IL-6, IL-1b, IL-23 oraz TGF beta. Zwieksza to limfocyty Th17 doprowadzajac np. do zapalenia stawow/artretyzmu.
Jakie czynniki zwiekszaja Th17?
– Przewlekly stres psychiczny/niepokoj. Przewlekly stres powoduje 'odpornosc’ na kortyzol/glikokortykosteroidy. Na dodatek powoduje to pogorszenie stanow autoimmunologicznych. Wyzszy poziom kortyzolu moze stlumic uklad immunologiczny. Stres powoduje, ze uwalniana jest epinefryna oraz zwieksza poziomy Th17, ktore staja sie dominujace w organizmie. Tacy ludzie nie dosc ze produkuja spore ilosci cytokin IL-17 to na dodatek inne cytokiny zapalne takie jak TNF alfa. U zdrowych ludzi, glikokortykosteroidy/kortyzol obnizaja nadmierna aktywacje limfocytow Th17 – niestety nie u osob mocno zestresowanych/niespokojnych/lekliwych, gdyz sa oni odporni na dzialanie glikokortykosteroidow. Rowniez adrenalina, ktora jest agonista receptora Beta2-AR, wzmaga odpowiedz IL-17. Tak samo robia to leki astmatyczne…
– Otylosc
– Dieta bardzo bogata w sol
– Wolne rodniki
– Bardzo intensywne cwiczenia/maratony
– Oleje do smazenia(chodzi o oleje rafinowane)/papierosy
– Zaklocenia rytmu dobowego
– Gluten
– Wirus grypy
– Aldosteron – zwieksza cisnienie krwi. Zdecydowanie promuje powstawanie limfocytow Th17
– Insulina(nadmiar)
– IGF-1
– Hormony takie jak leptyna(ktora jest z kolei podwyzszona u ludzi otylych)
– Adiponektyna (zwieksza komorki Th1 i Th17). Jest ona z kolei podwyzszona u niektorych ludzi chudych. Hormon ten jest znany ze swoich skutkow ubocznych zwiekszajacych wrazliwosc na insuline i z wlasciwosci przeciwnowotworowych. Jednakze moze byc takze markerem poczatku niektorych chorob sercowo-naczyniowych, wykazano ze jest bardzo aktywna w tkankach w stanie zapalnym u pacjentow z reumatoidalnym zapaleniem stawow / RZS i u osob z chorobami jelita grubego
Jakie suplementy(i inne rzeczy) zwiekszaja Th17?
– Probiotyczne bakterie takie jak L.casei, S.boulardii, Bacillus Subtilis – wszystkie zwiekszaja IL-17
– Rtec, Kadm, Arszenik i Olow
– infekcja bakteria Chlamydia
– Nadmiar jodu – wysokie poziomy prowadza do szybkiego podniesienia limfocytow Th1. Sam nie przekraczam 1 mg dziennie w 2 podzielonych dawkach.
– Tryptofan (wylaczajac enzym IDO)
– NAD+/Niagen – zwieksza Th17 i Th1 ale zmniejsza tez ich zdolnosc do powodowania chorob
– Oporna skrobia (np.niedojrzale banany czy uprzednio moczone i ugotowane i schlodzone platki owsiane)
Jak zahamowac Limfocyty Th17 i cytokine IL-17?
Rzeczy, ktore hamuja limfocyty Th1 przewaznie tez hamuja Th17. Cytokina IL-17 jest uwalniana przez limfocyty Th17,wiec blokujac je, blokujemy odrazu Il-17 i niedopuszczamy do dalszych szkod ktore one wyrzadzaja. Ponadto istnieja 2 bialka ktore umozliwaja powstawanie cytokiny IL-17 – STAT3 oraz czynnik transkrypcyjny Nf-kappaBeta(takze ich blokada automatycznie blokuje IL-17).
Co zmniejsza Th17?
– Lit hamuje Th1 ale nie hamuje Th17
– olej rybny (zmniejsza zarowno IL-6R jak i IL-23R)
– Lekkie cwiczenia
– Tlenek azotu (nie obniza Th1)
– Wyregulowanie rytmu dobowego
– Kielki brokulow/sulforafan
– Slonce/promienie UV
– Melatonina
– GABA(A)
– Witamina A/retinol
– Kortyzol
– Estradiol/Estrogen
– Progesteron
– Witamina D3
– Herbata jasminowa oraz EGCG (moje topowe ziolka w postaci naparow)
– Andrographis(a to z kolei topowe ziolo w postaci nalewki)
– Olej z czarnuszki
– Bakterie probiotyczne takie jak L.salivarius, L.plantarum
– Kurkumina
– Berberyna(potwierdzone nawet w badaniach klinicznych)
– Fisetyna(flawonoid wystepujacy miedzyinnymi w truskawkach)
– Tarczyca bajkalska/bajkalina
– Epimedium/ikaryna
– Apigenina
– Lukrecja
– Honokiol(np. z Magnoli)
– Artemesina
– NAG
– Ekstrakt z pestek winogron
– Boswelia
– R-ALA
– Lonicera Japonica
– Wszystko co hamuje bialko STAT3(jakby nie patrzec jest to b.wazna substancja bez ktorej limfocyty Th17 nie moga byc produkowane – to co hamuje STAT3 przedstawie w innym artykule)
– zmniejszenie cytokin IL-1beta, IL-6, bialka STAT1, obnizenie czynnika transkrypcyjnego HIF1a, zwiekszenie receptorow PPAR gamma i PPAR delta, zwiekszenie cytokiny przeciwzapalnej IL-10
– Zwiekszenie interferonow beta
STAT3 to bialko, ktore wiaze sie z DNA i zwieksza ekspresje genow. Wykazuje ono wazna role w przypadku chorob autoimmunologicznych, stanow zapalnych(i chorob z nimi zwiazanych) oraz w przypadku niektorych nowotworow. Inna substancja blokujaca wytwarzanie Th17 jest kinaza mTOR(ta sama ktora przyczynia sie do rozbudowy masy miesniowej, a ktorej hamowanie wydluza zycie czlowieka). Zwiekszony poziom mTOR promuje Th1 i Th17 przyczyniajac sie miedzyinnymi do stanow zapalnych w jelitach oraz naturalnie innych problemow zwiazanych ze stanami zapalnymi. W/w kinaza zwieksza takze czynnik HIF1 alfa(kinaza mTOR zwieksza glikolize przy udziale HIF1 alfa co przyczynia sie do namnazania komorek Th17) ktory z kolei zwieksza Th17 takze hamowanie mTOR jest kolejna metoda na obnizenie zarowno Th1 jak i Th17.
Post wydał Ci się wartościowy?a może po prostu mnie lubisz ;)?podziel się nim na Facebooku i go udostępnij!
Polub tego bloga na FB, gdzie znajdziesz też dodatkowe newsy, których tutaj nie publikuje https://www.facebook.com/zdrowiebeztajemnic
Obserwuj mnie na instagramie www.instagram.com/premyslaw84
Głosuj i wybieraj kolejne tematy – prawa strona bloga – zakładka „Ankieta”
cornetis.pl/artykul/3113.html
naukadlazdrowia.pl/kwas-kynureninowy-co-to-jest
phmd.pl/fulltxthtml.php?ICID=16585
czytelniamedyczna.pl/4848,receptory-betaadrenergiczne-w-sercu-na-marginesie-nagrody-nobla-z-chemii-w-2012.html
nature.com/ncomms/2014/141007/ncomms6101/full/ncomms6101.html
cell.com/cell-reports/fulltext/S2211-1247(12)00064-2
hindawi.com/journals/ecam/2011/548086/fig1/
ncbi.nlm.nih.gov/pubmed/19154614/
ncbi.nlm.nih.gov/pmc/articles/PMC3915289/
en.wikipedia.org/wiki/Kynurenic_acid
ncbi.nlm.nih.gov/pubmed/20336058
ncbi.nlm.nih.gov/pubmed/21085185?dopt=Abstract
sciencedaily.com/releases/2013/11/131107170632.htm
plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0047244#abstract0
nature.com/mi/journal/v7/n6/full/mi201417a.html
ncbi.nlm.nih.gov/pubmed/18354038
ncbi.nlm.nih.gov/pubmed/24193199
biomedcentral.com/1471-2466/14/84
ncbi.nlm.nih.gov/pubmed/21338381
ncbi.nlm.nih.gov/pubmed/24211715
plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0068446
ncbi.nlm.nih.gov/pubmed/21905024
jimmunol.org/cgi/content/meeting_abstract/188/1_MeetingAbstracts/123.30
ncbi.nlm.nih.gov/pubmed/22331486
ncbi.nlm.nih.gov/pubmed/20058616
ncbi.nlm.nih.gov/pubmed/20583102
ncbi.nlm.nih.gov/pmc/articles/PMC3704106/
ncbi.nlm.nih.gov/pmc/articles/PMC3704106/
ncbi.nlm.nih.gov/pmc/articles/PMC3299089/
ncbi.nlm.nih.gov/pubmed/18768865/
discoverymedicine.com/Spyros-I-Siakavellas/2012/10/26/role-of-the-il-23-il-17-axis-in-crohns-disease/
ncbi.nlm.nih.gov/pubmed/23345934
biomedcentral.com/1471-2466/14/84
plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0105238
jleukbio.org/content/92/6/1187.full
ncbi.nlm.nih.gov/pubmed/18432274
link.springer.com/article/10.1007%2Fs12032-013-0732-3
ncbi.nlm.nih.gov/pubmed/24021410
ncbi.nlm.nih.gov/pmc/articles/PMC3787652/
ncbi.nlm.nih.gov/pubmed/22511335
humrep.oxfordjournals.org/content/28/12/3283.abstract
ncbi.nlm.nih.gov/pubmed/18975343
ncbi.nlm.nih.gov/pubmed/23370232
ncbi.nlm.nih.gov/pubmed/20447453
ncbi.nlm.nih.gov/pubmed/23370232
ncbi.nlm.nih.gov/pubmed/20447453
onlinelibrary.wiley.com/doi/10.1002/eji.201242613/abstract
ncbi.nlm.nih.gov/pubmed/20621581
ncbi.nlm.nih.gov/pubmed/20865305
ncbi.nlm.nih.gov/pmc/articles/PMC3148409/
jimmunol.org/cgi/content/meeting_abstract/190/1_MeetingAbstracts/115.5
plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0074722
pnas.org/content/111/33/12163/suppl/DCSupplemental
onlinelibrary.wiley.com/doi/10.1002/eji.200838893/pdf
medpagetoday.com/Rheumatology/GeneralRheumatology/40685
sciencedaily.com/releases/2013/11/131107170632.htm
ncbi.nlm.nih.gov/pubmed/22428018
jem.rupress.org/content/211/12/2397.short?rss=1&utm_source=dlvr.it&utm_medium=twitter
ncbi.nlm.nih.gov/pubmed/24391210
jimmunol.org/content/188/6/2592.long
jimmunol.org/content/184/1/191.abstract
ncbi.nlm.nih.gov/pubmed/24033914
link.springer.com/article/10.1007/s12011-014-9958-y
ncbi.nlm.nih.gov/pubmed/19635913
ncbi.nlm.nih.gov/pubmed/17136028
ncbi.nlm.nih.gov/pubmed/23086919
ncbi.nlm.nih.gov/pubmed/21970527
ncbi.nlm.nih.gov/pubmed/24038094
ncbi.nlm.nih.gov/pmc/articles/PMC3787652/
pnas.org/content/109/4/1222.long
en.wikipedia.org/wiki/T_helper_17_cell
lsresearch.thomsonreuters.com/maps/2748/
plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0052658
ncbi.nlm.nih.gov/pubmed/23864512
utsouthwestern.edu/newsroom/news-releases/year-2013/nov/immune-clock-hooper.html
sciencedirect.com/science/article/pii/S001448861300304X
journal-inflammation.com/content/8/1/6
plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0054895
jimmunol.org/cgi/content/meeting_abstract/184/1_MeetingAbstracts/97.15
atsjournals.org/doi/abs/10.1164/ajrccm-conference.2012.185.1_MeetingAbstracts.A3860
ncbi.nlm.nih.gov/pubmed/23720815
ncbi.nlm.nih.gov/pubmed/23186919
humrep.oxfordjournals.org/content/28/12/3283.abstract
ncbi.nlm.nih.gov/pubmed/22193289
ncbi.nlm.nih.gov/pubmed/23203561
ncbi.nlm.nih.gov/pubmed/24033914
ncbi.nlm.nih.gov/pmc/articles/PMC3197781/
hindawi.com/journals/ecam/2011/548086/
bloodjournal.org/content/111/3/1013?sso-checked=true
ncbi.nlm.nih.gov/pubmed/20215335
plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0047244
ncbi.nlm.nih.gov/pubmed/23500387
ncbi.nlm.nih.gov/pubmed/23482469
ncbi.nlm.nih.gov/pubmed/23064699
ncbi.nlm.nih.gov/pubmed/23292349
ncbi.nlm.nih.gov/pubmed/24176234
ncbi.nlm.nih.gov/pubmed/19386399
ncbi.nlm.nih.gov/pubmed/20034219
ncbi.nlm.nih.gov/pubmed/22290391
ncbi.nlm.nih.gov/pubmed/25269538
ncbi.nlm.nih.gov/pubmed/21965673
ncbi.nlm.nih.gov/pubmed/24193199
plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0078843
ncbi.nlm.nih.gov/pubmed/20933009
ncbi.nlm.nih.gov/pubmed/24469975
ncbi.nlm.nih.gov/pubmed/23261528
ncbi.nlm.nih.gov/pubmed/23550596
ncbi.nlm.nih.gov/pubmed/24060907
ncbi.nlm.nih.gov/pubmed/20889543
ncbi.nlm.nih.gov/pubmed/24447171
wjgnet.com/1007-9327/full/v17/i8/976.htm
hindawi.com/journals/ecam/2011/548086/tab1/
ncbi.nlm.nih.gov/pubmed/22641478
nature.com/jid/journal/v130/n5/full/jid2009399a.html
nature.com/jid/journal/v130/n5/fig_tab/jid2009399f6.html#figure-title
sciencedirect.com/science/article/pii/S104346661200748X
ncbi.nlm.nih.gov/pubmed/23261528
ncbi.nlm.nih.gov/pmc/articles/PMC3135370/
ncbi.nlm.nih.gov/pubmed/20406305
ncbi.nlm.nih.gov/pubmed/19737866
ncbi.nlm.nih.gov/pubmed/17277312
ncbi.nlm.nih.gov/pmc/articles/PMC3928092/
ncbi.nlm.nih.gov/pmc/articles/PMC3135370/
Układ odpornościowy cz.1 – limfocyty Th1 i Th2

Układ odpornościowy ma niewiarygodnie wręcz duże znaczenie w życiu człowieka. Nie tylko może Cię ochronić przed infekcją wirusową, bateryjną czy rozprzestrzenieniem się grzybicy ale i ma bezpośredni wpływ na większość chorób, które obecnie nazywa się chorobami autoimmunologicznymi. Choroby z tej grupy oznaczają się jedną-wspólną cechą – kompletnym rozchwianiem układu odpornościowego. Może to być rozchwianie w kierunku zbyt wysokiej aktywności komórkowej limfocytów Th1(składająca się z cytokin inicjujących zapalenie) w których skład wchodzą takie cytokiny jak TNF-alfa, IL-2 czy też interferony-gamma jak i w stronę odpowiedzi humoralnej – Th2 (która tłumi stany zapalne) – IL-4, IL-5 IL-10. W zależności co jest u Ciebie zaburzone możesz z łatwością dzięki testowi krwi (dość drogie badanie) sprawdzić dominację danego ramienia ukł.odpornościowego i mu przeciwdziałać. Oczywiście zaburzenia układu dość rzadko spowodowane są tylko i wyłącznie nieprawidłową dietą mimo dzięki takiemu działaniu(zmianie diety) można dać sobie że tak powiem bezobjawowy czas ,aby znaleźć źródło problemu (infekcja bakteryjna, wirusowa, grzybiczna, pasożytnicza czy też np. metale ciężkie lub inne toksyny).
Kiedy dominuje ramię Limfocytów Th1
Odpowiedz komórkowa Th1 pobudza limfocyty (limfocyty T, Natural killers o których więcej pisałem już tutaj) oraz makrofagi powodując stan zapalny. Taka cytokina jak interferon gamma(IFN-gamma) hamuje wytwarzanie przeciwciał/białek IgG czy IgE oraz zwiększa uwalnianie białek IgM. Przetwarzanie żywności także ma znaczenie na przeciwciała – Takie procesy jak gotowanie/smażenie może zmienić białka np. mniejsza ilość przeciwciał IgM występuje w surowych orzeszkach niż w smażonych. W smażonym kurczaku, łososiu czy też puszkowanym tuńczyku jest np. więcej przeciwciał IgM niż w surowych mięsach.
Co sie dzieje kiedy Th1 dominuje tj.co powoduje jego podwyższony stan?(skutki negatywne)
– Wrażliwość na jedzenie która jest opóźniona – stany zapalne nie występują wtedy odrazu po zjedzeniu czegoś – będziesz je odczuwał po parudziesięciu minutach,po godzinie a może nawet i po 2.
– Mgła umysłowa – (może jednak ona pojawić się w także w dominacji th2)
– Przewlekłe zmęczenie – interferon gamma zwiększa także cytokinę IL-1b i TNF-alfa (cytokiny zapalne) – obydwie zwiększają zmęczenie poprzez zwiększenie neuronów oreksyny(hormon odpowiedzialny za sen czy za metabolizm). TNF-alfa może być także podwyższone przy dominacji Th2 gdyż ta cytokina jest także podwyższana poprzez IL-1 oraz komórki tuczne jednak w większości przypadków wysokie TNF jest klasycznym przykładem dominacji Th1
– IBS – ludzie z zespołem jelita drażliwego mają w większości dominację Th1 (podwyższona cytokina IL-12). Interferon redukuje u nich poziom serotoniny w jelitach oraz zwiększa stres oksydacyjny (poprzez aktywację enzymu IDO). Jakiś procent IBSowców może mieć jednak dominację Th2
– Reumatoidalne zapalenie stawów
– Choroba tarczycy Hashimoto (niedoczynność)
– niski poziom hormonu T3 – poziom T3 i/lub T4 są bardzo nisko jednak nie ma żadnego problemu z samą tarczycą(aTPO aTG są jak najbardziej ok a USG nie)
wykazuje żadnych nieprawidłowości). Dzieje się to poprzez podwyższone IL-6, interferon gamma oraz TNF-alfa i IL-1b
– Szczupła sylwetka ciała – jakiś procent osób z dominacją th1 są bardzo chudzi. Można to wytłumaczyć tym iż TNF alfa oraz IL-1beta hamują oreksynę, która z kolei hamuje apetyt.
– Choroba IBD/Leśniowskiego Crohna – charakteryzuje się wysokim poziomem limfocytów Th17 oraz cytokiny IL-18. Są one połączone z dominacją Th1
– Celiakia
– Cukrzyca typu 1
– Zespół policystycznych jajników (zwłaszcza cytokina IL-18)
– Choroba Alzheimera (także cytokina IL-18)
– Toczeń (głównie limfocyty Th2 jednak zdarzają się przypadki dominacji Th1)
– Stwardnienie Rozsiane (Tutaj zdarzają się przypadki dominacji Th2)
– Syndrom Guillain-Barra
– Choroba Behceta
– Borelioza
– CMV, H.Pylori, HPV/wirusy z grupy herpes
– zwiększone wydzielanie kortyzolu prowadzące do wyczerpania nadnerczy
– Niski poziom interferonu gamma przyspiesza starzenie się organizmu i przyczynia się do takich stanów jak depresja, lęki, bezsenność, upośledzenie procesów poznawczych/kognitywnych oraz takich chorób neurodegeneracyjnych jak RZS, osteoporoza czy cukrzyca. Niektóre badania wykazały, że może być również zamieszany w rozwój agresywnych nowotworów
Skutki pozytywne podwyższonych cytokin limfocytów Th1
– Mniejsza podatność na infekcje (jeśli interferon gamma jest na dostatecznie wysokim poziomie)(z kolei jeśli kortyzol jest nieco podwyższony, obniży on wartości Th1 przyczyniając się do podatności na infekcje)
– Obniżone ryzyko nowotworu ze względu na podwyższony TNF i interferon gamma – obydwie cytokiny działają niszczycielsko na komórki nowotworowe – jednak niestety i tutaj zbyt długo utrzymujący się podwyższony stan w/w cytokin sam w sobie może doprowadzić do nowotworu
Limfocyty Th2
Jest to ramie układu odpornościowego odpowiedzialne za odpowiedź humoralną, wytwarzanie przeciwciał i odpowiedź ukł.odpornościowego. Dominacja Th2 objawia się właściwościami przeciwzapalnymi, gdyż ludzie którzy mają podwyższoną tą odpowiedź odznaczają się niską odpowiedzią Th1. Osoby z wysokim Th2 bedą nie tylko posiadali zdolność do szybkiego tłumienia stanów zapalnych(lub wogóle do ich nie powstawania) ale i także zwiększoną podatność do alergi pokarmowych. Cytokiny wchodzące w skład w/w odpowiedzi to IL-4, która produkuje IgG1 oraz IgE jednak znacząco hamuje białka IgM, IgG3, IgG2a i IgG2b. Ludzie z dominacją
limfocytów th2 powinni zrobić test IgE na alergie z krwi oraz alergi skórnych. Tak jak już wcześniej pisałem, przetważanie żywności ma wpływ na przeciwciała i np. surowe jajka czy orzeszki wykazują niższe poziomy przeciwciał IgE niż ugotowane czy prażone. Inne cytokiny wchodzące w skład Th2 to IL-5,IL-4, IL-10 czy też IL-13.
Dominacja Limfocytów Th2 i cytokin wchodzących w ich skład(właściwości negatywne)
– Alergie wywoływane przez przeciwciała IgE (są to alergie wywołane natychmiastowo, które odczujesz zaraz po zjedzeniu danego produktu)
– Alergie sezonowe
– Zwiężenie dróg oddechowych(bronchokonstrykcja)
– Astma
– Egzema
– Katar sienny(alergiczny nieżyt nosa)
– Zwiększona kwasowość żołądka (GERD)
– Nadmiar histaminy
– (może to być równie dobrze nadmiar cytokiny TNF należącej do Th1)
– Autyzm(to samo jak wyżej – może to być równie dobrze podwyższone Th1)
– Zapalenie błony naczyniowej oka, choroba Gravesa-Basedowa, Sjorgena, Liszaj płaski
– Toczeń
– Może świadczyć o aktywności wirusa EBV
– Może świadczyć o aktywnej infekcji bakterią Chlamydia
Problemy zdrowotne związane z Th2 wynikają również z np. cytokiny IL-4 i przeciwciał IgE. Stymulują one komórki tuczne do uwalniania histaminy, serotoniny i leukotrientów które zwężają drogi oddechowe i pogarszają perystaltykę jelit.
Dominacja Th2 możę wynikać z infekcji pasożytniczej, wirusowej(np.wirus EBV) czy też poprostu z genetyki danego osobnika. Oczywiście istnieje możliwość podwyższonych obu ramion Th1 i Th2 jednak jest to raczej rzadkość – przeważnie zachodzi dominacja jednego z nich. Należy zaznaczyć iż zwiększenie poziomu Th2 może pomóc w zwalczeniu nowotworu jednak chroniczne(długotrwałe) podniesione poziomy tych limfocytów zwiększy ryzyko powstania raka np. piersi, raka jelita grubego czy też trzustki (i innych).
Podniesione poziomy limfocytów Th2(pozytywne aspekty)
– rzadkie i niskie poziomy stanów zapalnych oraz szybka możliwość wygaszenia już tych istniejących
– ze względu na podniosioną kwasowość żołądka można z większą łatwością pozbyć się pasożytów
Metylacja (przyłączanie grup metylowych jak i cykl metylacyjny wpływający na ogólny detoks organizmu między innymi z metali ciężkich) a stan układu odpornościowego. Ludzie, którzy mają dominację Th1 są hipometylatorami pewnych genów(tj.mają wolne przyłączanie się grup metylowych i dla takich osób podawanie metylowanych witamin z grupy B jest jak najbardziej wskazane) niektórych genów. Hipometylacja zachodzi także u ludzi ze stwardnieniem rozsianym i wynika to z podwyższonej homocysteiny(w tym przypadku podwyższone jest ramię Th1). Problemem u ludzi z dominacją Th1 jest produkcja zbyt dużych ilości interferonu gamma co może przyczyniać się do nietolerancji na niektóre produkty diety co objawi się dopiero po jakimś czasie od spożycia danego produktu – w dominacji Th2 jest z kolei odwrotnie tzn. metylacja genu interferonu gamma powoduje za małą produkcję tej cytokiny a zatem dochodzi do zwiększonych poziomów cytokin z grupy Th2.
W obydwóch dominacjach, niektóre geny są nadmiernie metylowane a niektóre niedostetecznie. Pomimo to, podkręcenie metylacji używając TMG,SAMe czy witamin z grupy B powinno wytłumić twój nadreaktywny i niezbalansowany system immunologiczny(w jakimś stopniu).
Post wydał Ci się wartościowy?a może po prostu mnie lubisz ;)?podziel się nim na Facebooku i go udostępnij!
Polub tego bloga na FB, gdzie znajdziesz też dodatkowe newsy, których tutaj nie publikuje https://www.facebook.com/zdrowiebeztajemnic
Obserwuj mnie na instagramie www.instagram.com/premyslaw84
Głosuj i wybieraj kolejne tematy – prawa strona bloga – zakładka „Ankieta”
ncbi.nlm.nih.gov/pmc/articles/PMC2685801/
jimmunol.org/content/156/2/558.short
ncbi.nlm.nih.gov/pmc/articles/PMC2685801/
sciencemag.org/content/236/4804/944.short
ncbi.nlm.nih.gov/pmc/articles/PMC2685801/
en.wikipedia.org/wiki/Food_intolerance#Pathogenesis
ncbi.nlm.nih.gov/pubmed/12839120
ncbi.nlm.nih.gov/pubmed/20596075
jimmunol.org/content/181/7/4461.full.pdf
ncbi.nlm.nih.gov/pubmed/9022014
ncbi.nlm.nih.gov/pubmed/21094253
ncbi.nlm.nih.gov/pmc/articles/PMC3994460/
en.wikipedia.org/wiki/Tumor_necrosis_factor_alpha
ncbi.nlm.nih.gov/pubmed/9022014
ncbi.nlm.nih.gov/pubmed/23376950
lrjournal.com/article/S0145-2126(04)00227-9/abstract?cc=y=?cc=y=
sciencemag.org/content/236/4804/944.short
ncbi.nlm.nih.gov/pmc/articles/PMC2685801/
en.wikipedia.org/wiki/T_helper_cell#Th1.2FTh2_Model_for_helper_T_cells
ncbi.nlm.nih.gov/pubmed/20447453
ncbi.nlm.nih.gov/pubmed/9627004
jimmunol.org/cgi/content/meeting_abstract/184/1_MeetingAbstracts/93.17
ncbi.nlm.nih.gov/pubmed/15249726
ncbi.nlm.nih.gov/pmc/articles/PMC1847474/
ncbi.nlm.nih.gov/pmc/articles/PMC3967304/
jimmunol.org/content/168/3/1087.long
jimmunol.org/cgi/content/meeting_abstract/186/1_MeetingAbstracts/165.2
medscape.com/viewarticle/545132_3
jem.rupress.org/content/208/3/469.full
ncbi.nlm.nih.gov/pmc/articles/PMC3543504/
ncbi.nlm.nih.gov/pubmed/23255246
jimmunol.org/content/early/2011/11/02/jimmunol.1101058.full.pdf
ncbi.nlm.nih.gov/pmc/articles/PMC3655339/
plosgenetics.org/article/info%3Adoi%2F10.1371%2Fjournal.pgen.1004059
ncbi.nlm.nih.gov/pubmed/16421120
ncbi.nlm.nih.gov/pubmed/18004650/
Probiotyki – ich właściwości i wpływ na układ immunologiczny

Temat probiotyków jest tak rozległy, że można by było o nich napisać kilkutomową encyklopedię. Przerobiłem przeogromną ilość literatury ogólnodostępnej na ten temat w poszukiwaniu ich bezpośredniego wpływu na układ immunologiczny (zależało mi na szczegółowych właściwościach poszczególnych szczepów). W trakcie studiowania immunologicznych aspektów pożytecznych bakterii, pogłębiłem również swoją wiedzę na temat ogólnych ich właściwości , którą chciałbym się teraz z Tobą podzielić. Temat rozbije zatem na 2 posty, aby trochę łatwiej się to studiowało.
Probiotyki uszczelniają ogólnie rzecz biorąc ściany nabłonka jelitowego tak, aby nie przedostawały się przez niego do krwi szkodliwe substancje, poprawiają funkcjonowanie śluzówki układu pokarmowego, stymulują działanie układu odpornościowego, syntetyzują substancje odżywcze i ułatwiają ich biodostępność, łagodzą objawy nietolerancji laktozy, redukują ryzyko pojawienia się alergii u obciążonych nim osób oraz zmniejszają prawdopodobieństwo wystąpienia niektórych nowotworów.
Specyficzną cechą niektórych bakterii probiotycznych jest ich zdolność przedostawania się w stanie żywym do jelita grubego, osiedlania się w nim i rozmnażania. Oddziałują one korzystnie na stan zdrowotny przewodu pokarmowego, a w konsekwencji na stan naszego zdrowia.
Istnieje coś takiego jak jelitowy układ nerwowy który składa się z setek milionów komórek nerwowych zdolnych do porozumiewania się i do przekazywania informacji do mózgu jak i innych organów. Układ ten znajduje się w jelicie cienkim,żołądku, trzustce czy też pęcherzyku żółciowym. Pełni on takie funkcję jak(między innymi):
– regulacja perystaltyki, ruchów jelitowych, skurczów mięśniówki jelit
– wydziela enzymy trawienne, które rozdrabniają pożywienie na małe cząsteczki
– uczestniczy w regulacji ruchów perystaltycznych przełyku, pomagając przesunąć pożywienie do żołądka
– ruchy perystaltyczne pęcherzyka pozwalają na wydzielenie żółci do dwunastnicy
– pomaga w wydzielaniu hormonów uwalniających enzymy trzustki
– zmienia wydzieliny i elektrolity w przewodzie pokarmowym
– towarzyszy przepływowi krwi przez śluzówkę jelit
– reguluje pracę zwieraczy przewodu pokarmowego i przełyku, zapobiegając cofaniu się pokarmu do jamy ustnej i pozwalając przesuwać go z żołądka do dwunastnicy (tj.zapobiega objawom refluksu)
– używa praktycznie wszystkich neuroprzekaźników do funkcjonowania w tym serotoninę, GABA, dopaminę czy acetylocholinę
W 2011 roku Journal of Neurogastroenterology opublikowało arta z którego wynikało, że bifidobacteria longum pobudza wew.układ nerwowy i wysyła sygnały, które aktywują ścieżkę nerwu błędnego na poziomie jelitowego układu nerwowego – dowodzi to bezpośredniego związku aktywności i ilości bakterii jelitowych na zachowanie i naturalnie zdrowie człowieka.
Udowodniono że nieszczelność jelit, infekcja przewodu pokarmowego i depresja są ze sobą powiązane poprzez przepływ bakterii i patogenów jelito->mózg i zmianę w funkcji neuroprzekaźników. Przykład?powiązanie streptococusa z nerwicą natręctw i zespołem Touretta jak i związany z tym dysbalans immunologiczny wywołujący anginę czy też infekcję mózgu.
Naukowcy dowiedli, że brak balansu pomiędzy złymi a dobrymi bakteriami układu trawiennego ma duży udział w rozwoju przewlekłych schorzeń, takich jak choroby autoimmunologiczne, zespół metaboliczny, cukrzyca, otyłość, zespół przewlekłego zmęczenia czy niealkoholowe stłuszczenie wątroby. Suplementacja dobrych bakterii zapewnia ochronę przed chorobami jelitowymi, takimi jak zapalenie jelit(IBD), zespół jelita drażliwego (IBS) i nowotwór jelita grubego czy też powstrzymuje nadmierne starzenie się organizmu.
Ocenia się, że w jelitach znajduje się ok.100 trylionów mikroorganizmów, 400-1000 różnych gatunków bakterii i jest to ok.80% całkowitej obrony immunologicznej organizmu. W badaniach wykazano, że podczas karmienia piersią następuje wytworzenie się(implantacja) flory bakteryjnej w jelitach noworodka – karmienie piersią znacznie zmniejszyło ryzyko wystąpienia astmy wieku dziecięcego. Karmienie piersią przez ok.12 miesięcy zabezpiecza przed rozwojem RZS a zbyt krótkie karmienie może spowodować rozwój nadbopudliwości u dzieci – ADHD. Naturalnie każdy probiotyk ma swoje indywidualne właściwości, które ogólnikowo i w niektórych przypadkach szczegółowo chciałbym scharakteryzować.
– Bifidus infantis 35624 – może powodować zmniejszenie depresji, redukuje zespół jelita drażliwego.
Laktobacilus reutris – cofa stany antylękowe a także silnie pobudza układ immunologiczny (zwłaszcza cytokinę zapalną TNF alfa co jest bardzo niekorzystne u ludzi z RZS,Crohnem i ogólnie u wszystkich z autoagresję w tym i naturalnie Hashimoto). Powoduje zmianę aktywności neuroprzekaźnika GABA w układzie nerwowym.
– Lactobacillus rhamnosous – likwiduje stres, lęki i depresję
Lactobacillus Helveticus – likwiduje stres, lęki i depresję
– Bifidus lopngus – likwiduje stres, lęki i depresję
– Pałeczki Lactobacillus i Bifidobacterum ułatwiają proces trawienia białek, cukrów(prostych i złożonych) oraz tłuszczów, zwiększają absorbcję witamin i minerałów, zwiększają oporność fizjologiczną mikroflory bakteryjnej na działanie antybiotyków, łagodza odczyny zapalne wywołane przez bakteri, grzyby(Candida) i wirusy(np. biegunki wywołane przez rotawirusy), osłabiają reakcje alergiczne, wzmagają antybakteryjne i antygrzybiczne czy też antywirusowe reakcje odpornościowe, mają działanie przeciwnowotworowe, redukują eliminacje produktów katabolizmu białek, tłuszczów i węglowodanów przez nerki i wątrobę, zmniejszają poziom cholesterolu w surowicy i ograniczają osteoporozę.
Wyniki badań naukowych odkryły związek pomiędzy różnymi szczepami Lactobacillus (Lactobacillus acidophilus, Lactobacillus paracasei i Lactobacillus rhamnosus) oraz wzrostem cholesterolu HDL. Wykryto również powiązanie pomiędzy szczepami Bifidobacterium (Bifidobacterium lactis, Bifidobacterium bifidum i Bifidobacterium longum) a poprawą kontroli cukru we krwi, zmniejszeniem stanów zapalnych wątroby i redukcją uszkodzeń DNA, które mogą powodować rozwój komórek nowotworowych.
Wpływ bakterii probiotycznych na reakcje odpornościowe
Najliczniej reprezentowane w mikroflorze jelitowej sa takie gatunki jak Bacterioides, Eubacterium, Peptostreptococcus, pałeczki rodziny Enterobacteriacae, Bifidobacterium, Streptococcus, Lactobacillus, Clostridium i Staphylococcus. Niektóre z tych drobnoustrojów są patogenne, a inne wywierają korzystne działanie. Dlatego kolonizacja układu pokarmowego przez określone gatunki drobnoustrojów ma znaczny wpływ na ogólne uwarunkowania zdrowotne (podatność na infekcje, alergie, efekty toksyczne i karcynogenne). Takie czynniki jak: wiek, przyzwyczajenia żywieniowe, stan immunologiczny, stosowanie antybiotyków, stres, alkohol, oraz pH treści jelitowej, czasokres pasażu treści pokarmowej i jej skład wpływają na skład mikroflory jelitowej i jej aktywności metaboliczne.
Probiotyki a układ odporności wrodzonej
Bakterie probiotyczne wpływają stymulująco na układ odporności naturalnej poprzez: a) wzmaganie aktywności fagocytarnej granulocytów oraz makrofagów oraz ich właściwości bójczych i cytostatycznych, b) aktywację komórek natural killers-NK(o których pisałem już tutaj), c) indukcję syntezy cytokin zapalnych jak i przeciwzapalnych, d) modulację zdolności prezentacji antygenu limfocytom T
Zwiększanie aktywności enzymatycznej i fagocytarnej makrofagów i granulocytów
Wzmaganie przez probiotyki aktywności enzymatycznej i fagocytarnej makrofagów i granulocytów obserwowano zarówno in vitro, tj. po ich dodaniu do hodowli zawierających te komórki jak i in vivo – iniekcja dootrzewnowa (u myszy) i podanie doustne (u myszy i człowieka). Pozytywny efekt uzyskiwano zarówno przy zastosowaniu żywych szczepów bakterii probiotycznych jak i zabitych bakterii lub ich produktów. Efektywność działania zależy od zastosowanych szczepów bakterii i drogi ich podania, tj. parenteralnie lub per os. Np. u myszy już w 2 dni po podaniu dootrzewnowym L.bulgaricus 10-krotnie zwiększał się poziom enzymów lizosomalnych §-galaktozydazy, §-glukuronidazy, dehydrogenazy mleczanowej) w makrofagach, przy czym żywe bakterie wywoływały większy efekt niż martwe. Szczep L.casei był mniej efektywny (tylko 3-krotny wzrost poziomu enzymów), przy użyciu żywych i martwych bakterii. Oba szczepy podane per os były jednakowo efektywne, indukując większą aktywność enzymatyczną makrofagów w przypadku użycia żywych bakterii. W 2 dni po podaniu dootrzewnowym L.bulgaricus kilkakrotnie zwiększała się aktywność fagocytarna makrofagów, utrzymując się na tym poziomie do 8 dnia; przeciwnie, po podaniu per os fagocytoza wzrastała tylko nieznacznie, natomiast L.casei podane dootrzewnowo jak i per os jednakowo wzmagały fagocytozę.
Dootrzewnowe podanie L.casei zwiększało także aktywność fagocytarną komórek układu siateczkowo-śródbłonkowego. Wzrost aktywności fagocytarnej i enzymatycznej makrofagów wywoływały nie tylko żywe lub martwe pałeczki Lactobacillus, lecz także ich produkty: a) ekstrakty białkowe Bidobacterium longum, lecz nie L.acidophilus zwiększały poziom fosfodiesterazy alkalicznej (hydrolaza) w makrofagach; ekstrakty z obu szczepów jednakowo wzmagały fagocytozę cząsteczek akrylamidu lub żywych bakterii S.typhi murium, b) fosfopolisacharydy pochodzące ze szczepu L.dulbrueckii ssp. bulgaricus, podane dootrzewnowo, zwiększały zarówno liczbę makrofagów, ich aktywność cytostatyczną wobec linii komórek nowotworowych: sarcoma – 180 oraz P388, oraz aktywność fagocytarną (cząsteczek lateksu). L.casei był bardziej efektywny aniżeli L.bulgaricus.
Aktywacja komórek NK
Niektóre szczepy jak Bidobacterium lactis HN019 oraz L.rhamnosus HN001 u człowieka, lub szczepy L.rhamnosus HN001, DR20TM, L.acidophilus HN017, Bifidobacterium lactis HN019 na modelu mysim silnie zwiększały ilość komórek natural killers NK, które wykazywały wzmożony efekt cytotoksyczny in vitro wobec linii komórek nowotworowych K-562.
W pełni zdrowy system immunologiczny jelit faworyzuje produkcję immunoglobuliny IgA oraz cytokin z grupy limfocytów Th2 niż Th1 – innymi słowy bardziej wycisza niż nasila procesy zapalne. Jednak w przypadku takich chorób jak wrzodzejące zapalenie jelita grubego (które spowodowane jest nadreaktywnością limfocytów Th2) czy też choroba Lesniowskiego-Crohna(zwiększone wytwarzanie cytokin prozapalnych limfocytów Th1) pokazują wyraźną dominację Th1 lub Th2.
Wszystkie bakterie probiotyczne są w stanie pobudzić wytwarzanie określonych cytokin – np. Lactobacillus sakei wzmaga produkcję zapalnych cytokin IL-1, IL-8 oraz TNF. Z kolei Lactobacillus Johnsonii wzmaga produkcję -beta(o tej cytokinie pisałem już wcześniej tutaj). Udowodniono również, że poszczególne szczepy bakteri mają najróżniejsze oddziaływanie na system odpornościowy takie jak np. zwiększenie fagocytozy czy aktywności komórek NK(troche więcej o tych komórkach pisałem już tutaj).
Balansowanie syntezy cytokin
Wiele szczepów pałeczek Lactobacillus po kontakcie in vitro z populacją jednojądrzastych komórek ludzkiej krwi obwodowej aktywuje te komórki do syntezy cytokin zapalnych, takich jak TNF-alfa, IL-6, IL-10, IL-12, IL-18, IFN-gamma. Wszystkie one (z wyjątkiem IL-10) należą do tzw. „prozapalnych” cytokin typu Th1. Zakres ich syntezy zależy od stosowanego szczepu Lactobacillus. Niektóre szczepy jak L.rhamnosus, B.animalis czy L.acidophilus były silnymi induktorami TNF-alfa i IL-6 in vitro, a inne (B.longum, B.lactis L.paracasei, E.lactis) słabymi.
Większość z badanych szczepów pałeczek Lactobacillus wzmagała syntezę cytokiny IL-10(zmniejsza stany zapalne) in vitro w podobnym zakresie ilościowym.
Podawanie probiotyków per os w postaci zawiesiny bakterii lub w mleku fermentowanym wzmagało prozapalne aktywności leukocytów krwi obwodowej manifestujące się poprzez: a) samoistną syntezą Interferonu-gamma w hodowli leukocytów in vitro, b) zwiększoną poziom interferonów (IFN-alfa i IFN-gamma) c) wzrost poziomu Interferonu-gamma w surowicy. Nie zidentyfikowano komórek odpowiedzialnych za te aktywności. Prawdopodobnie były to komórki NK lub/i limfocyty T. Podawanie priobiotyków per os wzmagało też zdolność limfocytów krwi obwodowej do syntezy IL-2(cytokina zapalna) po aktywacji tych komórek in vitro przez mitogeny limfocytów T. Wyniki te wskazują, że probiotyki mogą wzmagać niektóre prozapalne aktywności limfocytów (synteza cytokin Th1).
Czy jest to pożądane zjawisko? Z jednej strony tak, ponieważ obecność tych cytokin determinuje działanie antyinfekcyjne (antywirusowe i antybakteryjne). Z drugiej strony nie, ponieważ może powodować nadmierne reakcje zapalne, co w warunkach in vivo jest niekorzystne(zwłaszcza jeśli chodzi o choroby autoimmunologiczne). Cytokiny mają bowiem decydujące znaczenie efektorowe (wzmaganie wielu komórkowych reakcji odpornościowych) jak i regulacyjne (zachowanie równowagi czynnościowej pomiędzy pro i przeciwzapalnymi reaktywnościami komórek układu odpornościowego, tj. odpowiednio Th1 i Th2 zależnymi).
Regulacja poziomu i profilu cytokin syntetyzowanych komórki układu odpornościowego przez bakterie probiotyczne w znacznej mierze zależy od kompozycji gatunków i szczepów danego gatunku oddziałowujących na komórki układu odpornościowego. Np. kombinacja szczepów L.acidophilus, L.bulgaricus i B.bifidum, wchodzących w skład preparatu Trilac (Alergon, Gšteborg, Szwecja), zwiększa wytwarzanie TNF-alfa (cytokina prozapalna) i IL-10 (przeciwzapalna), przy praktycznie braku IFN-gamma i niskim poziomie IL-12 (cytokiny zapalne). Przeciwnie, L. acidophilus z tego samego preparatu, jest silnym induktorem IL-12, IFN-gamma, i TNF-alfa przy słabej aktywności IL-10(w pojedynkę zatem wzmaga stany zapalne). Tak więc odpowiednia kombinacja szczepów pałeczek Lactobacillus determinuje ich probiotyczne właściwości w odniesieniu do reakcji odpornościowych, manifestujace się: a) słabą aktywnością prozapalną (słaba aktywność IL-12, IFN-g), b) możliwością działania antyinfekcyjnego (poprzez aktywności TNF-alfa), c) działaniem przeciw zapalnym (poprzez IL-10). Potwierdzeniem tych obserwacji były badania in vivo, wykazujące że tylko nieliczne szczepy Lactobacillus podane per os (tutaj L.reuteri i L.brevi) wywoływały u myszy syntezę prozapalnych cytokin w obrębie kosmków jelitowych.
– l.casei,l.salirarius, lactobactilus raumosus, bifidobacterium bactis, l.reuteri zwiekszają poziom limfocytów th2(przeciwzapalne właściwości)
– bifidobacterium bifidum, bifidobacterium animals zwiekszaja th1 i stan zapalny
– Lactobacillus acidophilus szczep 0356, Lactobacillus plantarum, Lactobacillus paracaseii szczep NCC2461 – zwiększają poziomy limfocytów Th1
– Lactobacillus acidophilus szczep La-14 IgG i Lactobacillus acidophilus szczep NCFM IgA, IgM – zwiększają limfocyty Th2 (czyli odpowiedz przeciwzapalną)
– Lactobacillus paracasei – DSM13434, Lactobacillus plantarum – DSM15312, Lactobacillus plantarum – DSM15313 – modulują tj.balansują cały układ odpornościowy(poprzez limfocyty T regulacyjne)
Bakterie fermentacji mlekowej:
Lactobacillus acidophilus to względnie beztlenowa pałeczka Gram-dodatnia. Wraz z kilkunastoma innymi gatunkami bakterii rodzaju Lactobacillus powszechnie zasiedla środowisko roślinne i zwierzęce, a także wchodzi w skład naturalnej flory przewodu pokarmowego człowieka. Występuje w mikroflorze jamy ustnej, we wszystkich odcinkach przewodu pokarmowego, w układzie moczowo-płciowym, a szczególnie często kolonizuje pochwę u kobiet. Najczęściej identyfikowane gatunki oprócz Lactobacillus acidophilus to: Lactobacillus casei i Lactobacillus fermenrum. Bakterie te powszechnie nazywane bakteriami kwasu mlekowego są również wykorzystywane w przemyśle spożywczym do przeprowadzania fermentacji mleka i produkcji jogurtów czy kefirów. Współczesne obserwacje potwierdzają, że zarówno ludzie jak i zwierzęta nie posiadające w przewodzie pokarmowym bakterii kwasu mlekowego są bardziej podatne na zakażenia jelitowe, powodujące w konsekwencji zaburzenia równowagi drobnoustrojowej przewodu pokarmowego gospodarza. Z kolei powstałe zaburzenia w składzie flory fizjologicznej układu trawiennego prowadzą do:
Eliminacji naturalnych producentów witamin z grupy B czy K oraz upośledzenie wchłaniania wapnia i przyswajania żelaza. Dysbakteriozy, czyli do nadmiernego namnażania – wobec braku naturalnej konkurencji – bakterii patogennych oraz nadkarzania bakteriami i grzybami. Skutkiem tego jest upośledzenie procesów wchłaniania tłuszczów oraz wzmożone wydalanie tłuszczów z kałem. Poza tym wzrost stężenia kwasów żółciowych i wzrost stężenia nie wchłoniętych produktów prowadzi do podrażnienia śluzówki przewodu pokarmowego i do utraty wody i elekrolitów, czyli biegunki. Dochodzi również do zaburzenia wchłaniania białek, węglowodanów i wzrostu procesów fermentacyjnych. Rzekomo błoniastego zapalenia jelita grubego wywołanego przez Clostridium difficile, którego pierwotną przyczyną jest przewlekła antybiotykoterapia. Antybiotyki, które najczęściej wywołują poantybiotykowe zapalenie jelit to: neomycyna, linkomycyna, klindamycyna i cefazolina.
Lactobacillus acidophilus ma zdolność zapobiegania i leczenia tych zaburzeń na drodze hamowania rozwoju bakterii patogennych.
Wykazano, że Lactobacillus działają antagonistycznie na pałeczki Gram-ujemne, takie jak: Shigella, Salmonella, Klebsiella, Escherichia colli; na ziarenkowce Gram-dodatnie, takie jak np. gronkowiec złocisty i na grzyby np. Candida albicans.
Lactobacillus acidophilus ma zdolność neutralizowania amin toksycznych i hamowania procesów gnilnych w jelicie i na tej drodze również przywraca równowagę drobnoustrojową przewodu pokarmowego.
Istnieją także wstępne badania, zakończone bardzo pozytywnymi wynikami, na temat redukcji poziomu cholesterolu dietą zawierającą pałeczki Lactobacillus acidophilus.
Udokumentowano również stymulujący wpływ Lactobacillus acidophilus na układ odpornościowy, polegający na wzroście aktywności makrofagów i limfocytów. Efektem tego jest wzrost siły i skuteczności odpowiedzi typu komórkowego układu odpornościowego(th1)
Z szeregu wymienionych, cennych właściwości jakie posiada Lactobacillu acidophilus i inne pałeczki kwasu mlekowego wynikają wskazania do jej zastosowania (z wyłączeniem osób z autoagresją układu immunologicznego). Są to wszystkie stany, które zaburzają równowagę flory bakteryjnej przewodu pokarmowego takie jak:
antybiotykoterapia, sterydoterapia, głodzenie, zatrucie pokarmowe, antykoncepcja doustna, zapalenia jelit spowodowane bytowaniem złych bakteri (krótkotrwała kuracja tylko po to aby przywrócić równowagę mikroflory bakteryjnej z tego względu iż acidophilus wzmaga syntezę cytokin zapalnych), nadużywanie alkoholu, nadużywanie kofeiny, chlorowana i fluorowana woda, stres, Są to również te stany, w których zostaje zaburzona równowaga flory bakteryjnej w innych miejscach bytowania pałeczki kwasu mlekowego: zakażenia układu moczowego, zakażenia układu płciowego.Na szczególną uwagę zasługuje bardzo duża skuteczność Lactobacillus acidophilus w leczeniu zakażeń grzybami Candida albicans o których pisałem już tu, tu, tu, i tu.
Grzybica może rozwinąć się w wyniku zastosowanej antybiotykoterapii lub pod wpływem jednego z czynników wymienionych powyżej i doprowadza do biegunki, zaparć lub innych zaburzeń trawienia. Grzybica może pojawić się poza przewodem pokarmowym np.: w płucach, na rękach, nogach, palcach, pod paznokciami bądź w pochwie. Także trądzik i inne problemy skórne mogą być leczone przez Acidophilus.
Pożyteczne bakterie i ich prozdrowotne właściwości w organiźmie kobiety
Bakteryjne szczepy Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C posiadają właściwości, dzięki którym wywierają korzystne działanie w organizmie kobiety.
Według ekspertów z Organizacji Narodów Zjednoczonych ds. Wyżywienia i Rolnictwa (FAO) i Światowej Organizacji Zdrowia (WHO) w przypadku probiotyków ginekologicznych wskazane jest zastosowanie w preparacie dwóch lub więcej szczepów probiotycznych.Szczepy Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C zostały wyizolowane z pochwy zdrowej kobiety jako naturalna triada, gdzie współdziałały
przy wywieraniu korzystnych efektów. Już pochodzenie tych szczepów sprawia, że są one dedykowane specjalnie dla kobiet.
Wykazano, że istnieją różnice w składzie mikroflory pochwy kobiet pochodzących z różnych regionów geograficznych. Dlatego też należy zwracać uwagę, czy bakterie probiotyczne pochodzą z rejonu, w którym są stosowane przez pacjentki. Mikroflora pochwy zdrowych Polek jest zdominowana głównie przez szczepy bakterii należące do tzw. kompleksu Lactobacillus acidophilus (35%), w tym Lactobacillus gasseri oraz szczepy Lactobacillus fermentum (30%) i Lactobacillus plantarum (30%). Tak więc szczepy Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C, które zostały wyizolowane z pochwy zdrowej Polki, są idealne dla polskich kobiet.
Aby szczepy probiotyczne mogły wywierać korzystny wpływ na zdrowie gospodarza muszą nie tylko zostać do niego dostarczone, ale również muszą zasiedlić jego organizm. Zasiedlenie jest możliwe dzięki adherencji komórek bakterii, która następuje poprzez ich łączenie się z odpowiednimi receptorami zlokalizowanymi na powierzchni komórek gospodarza. Adherencja do tkanki umożliwia rozwój i namnażanie się bakterii probiotycznych, a kolonizacja tkanek znacząco obniża ryzyko zasiedlenia skolonizowanych tkanek przez mikroorganizmy patogenne.
W badaniach wykazano, że bakteryjne szczepy Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C posiadają zdolność do adherencji zarówno do komórek linii komórkowej nabłonka pochwy A431, jak również do komórek linii Caco-2 i linii HT-29 MTX, które reprezentują komórki nabłonka jelitowego. Jest to cecha,która umożliwia wspomnianym szczepom kolonizację nabłonka pochwy i odbytu, co zostało udowodnione w przeprowadzonych badaniach klinicznych. Niezwykle korzystną dla probiotyków cechą jest zdolność do koagregacji, która sprzyja kolonizacji środowiska oraz tworzeniu biofilmu. W trakcie przeprowadzonego badania klinicznego potwierdzono występowanie zjawiska koagregacji pomiędzy komórkami szczepów bakteryjnych Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C. Wykazują one zwiększoną skuteczność kolonizacji środowiska, pokonując wspólnie niesprzyjające warunki w nim panujące.
Ważną cechą bakterii kwasu mlekowego jest działanie antagonistyczne względem patogennych bakterii i grzybów. Odbywa się ono m. in. na drodze konkurencji o składniki odżywcze, syntezę swoistych związków antybakteryjnych (m.in. bakteriocyn), czy obniżanie pH środowiska poprzez produkcję kwasu mlekowego. Ponadto bakterie z rodzaju Lactobacillus blokują miejsca adherencyjne występujące na powierzchni nabłonka, co
w znaczącym stopniu uniemożliwia jego zasiedlanie przez mikroorganizmy patogenne. Badania naukowe wykazały, że mieszanina szczepów Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C wykazuje właściwości antagonistyczne względem bakterii i grzybów patogennych, m.in. takich jak uropatogenny szczep Escherichia coli, Streptococcus agalactiae, Gardnerella vaginalis, Prevotella bivia, Candida albicans, będących najczęstszą przyczyną infekcji układu moczowo-płciowego, jak również Clostridium difficile, Staphylococcus aureus i Enterococcus faecalis. Ponadto omawiane szczepy probiotyczne mają zdolność do hamowania adhezji patogenów do powierzchni komórek linii komórkowej nabłonka pochwy A431, ograniczając w ten sposób możliwość rozwoju infekcji.
Zdolność przetrwania układu pokarmowego
Sok żołądkowy i sole żółci wytwarzają warunki, w których nie wszystkie bakterie są w stanie przeżyć. Bakterie, które nie są odporne na działanie takich czynników, nie przetrwają pasażu jelitowego, nie zasiedlą miejsca docelowego, a w konsekwencji nie będą korzystnie oddziaływały na organizm gospodarza. Oporność na działanie soli żółci i sztuczny kwas żołądkowy jest cechą charakteryzującą szczepu Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C, które, dzięki tym właściwościom, przeżywają pasaż jelitowy i mogą pełnić swoje funkcje w organizmie gospodarza.
Niezwykle skutecznym mechanizmem antagonistycznego działania bakterii kwasu mlekowego względem patogennej flory pochwy jest produkcja nadtlenku wodoru. Nadtlenek wodoru produkowany przez bakterie z rodzaju Lactobacillus może hamować wzrost bakterii, szczególnie beztlenowych. Bakterie produkujące nadtlenek wodoru są niezwykle istotnym składnikiem mikroflory zdrowej pochwy, a ich liczebność zdecydowanie maleje w przypadku przewlekłych stanów zapalnych pochwy oraz w okresie ciąży. Brak w środowisku pochwy bakterii produkujących nadtlenek wodoru wiąże się ze zwiększoną częstością występowania nawrotowych bakteryjnych waginoz pochwy. Dlatego też organizacje FAO i WHO zalecają, aby szczepy kolonizujące pochwę posiadały zdolność produkcji nadtlenku wodoru. Badania wykazały, że szczep Lactobacillus gasseri 57C należy do elitarnej grupy bakterii posiadającej tą pożądaną dla probiotyków zdolność.
Istotną właściwością probiotyków ginekologicznych, zalecaną przez Organizację Narodów Zjednoczonych ds. Wyżywienia i Rolnictwa (FAO) oraz Światową Organizację Zdrowia (WHO), jest oporność na działanie środków plemnikobójczych. W badaniach wykazano, że preparat zawierający szczepy Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C wykazuje oporność na działanie spermicydu, jakim jest nonoksynol-9 . Ponadto, probiotyczne szczepy Lactobacillus fermentum 57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C wykazują typową dla gatunków lekooporność. Są oporne na metronidazol, ciprofloksacynę, norfloksacynę i kwas nalidyksowy i mogą być skutecznie stosowane m.in. w trakcie terapii wspomnianymi antybiotykami i chemioterapeutykami.
Rola probiotyków w leczeniu nowotworów
Naukowcy wykazali, że organizmy probiotyczne włączają ochronne mechanizmy sygnalizacyjne, które:
– tłumią bakterie, które przekształcają cząsteczki pro-nowotworowe w karcenogenne
– wiążą się z potencjalnymi karcenogenami, wspomagając ich wydalanie
– redukują enzymy związane z rozwojem czynników nowotworotwórczych
– zwiększają populację komórek odpornościowych, które odgrywają istotną rolę w hamowaniu nowotworów
– regulują immunologiczne cytokiny do walki na wczesnym stadium nowotworu lub innych zagrożeń(ważny jest dobór odpowiednich typów i szczepów bakteri)
– tłumią reakcję zapalną gdy słabnie zagrożenie infekcją czy nowotworem(ważny jest dobór odpowiednich typów i szczepów bakteri)
Odpowiednio zbilansowana flora bakteryjna wytwarza biologicznie aktywne białka, które przedostają się do krwi. W ten sposób, „dobre” bakterie hamują rozwój licznych chorób przewlekłych, wliczając w to otyłość, cukrzycę, zespół metaboliczny, choroby sercowo-naczyniowe, nowotwory czy infekcje układu oddechowego. Dzisiejsza dieta, styl życia, praktyki lekarskie i inne czynniki mają tendencję do zakłócania równowagi bakteryjnej jelit.
Dowody wskazują, że suplementacja kluczowych szczepów przywraca odpowiednią równowagę korzystnych bakterii, co z kolei odbudowuje naturalną funkcję jelit, chroniącą przed wieloma chorobami.
Lactobacillus i Bifidobacteria, dwa najlepiej poznane gatunki, jak wykazano, wspomagają funkcjonowanie jelit oraz okazują się być pomocne w leczeniu zarówno biegunki jak i zaparć.
Cukrzyca i zespół metaboliczny. Jak wykazano podczas badań klinicznych przeprowadzonych na ludziach oraz zwierzętach, probiotyki zawierające Lactobacillus i Bifidobacteria wpłynęły na poprawę insulinooporności i znaczne zmniejszenie stężenia cukru we krwi. Podczas 6-tygodniowej próby, wśród pacjentów z cukrzycą typu II, badanie na czczo glukozy oraz hemoglobiny A1c (miara długoterminowej kontroli cukru we krwi) uległy znacznej poprawie dzięki spożywaniu jogurtów probiotycznych zawierających Lactobacillus acidophilus i Bifidobacterium lactis. Odnotowano również wzrost całkowitego poziomu antyoksydantów.
Otyłość. Istnieje związek pomiędzy nadużywaniem antybiotyków a otyłością. Badania przeprowadzone na zwierzętach oraz ludziach wykazały, że suplementacja probiotyków wspomaga redukcję wagi ciała i gromadzenia tłuszczu. Podczas prób zaobserwowano, że probiotyki podawane matkom w okresie prenatalnym , wywołały redukcję przyrostu masy u kobiet oraz ich dzieci.
Choroby układu sercowo-naczyniowego. Jak wykazały wyniki badań przeprowadzonych na ludziach oraz zwierzętach, stosowanie probiotyków zmniejsza poziom cholesterolu całkowitego oraz LDL a zwiększa HDL. Ostatnie próby sugerują, że suplementacja dobroczynnych bakterii może zmniejszyć wchłanianie cholesterolu oraz zredukować stany zapalne związane z magazynowaniem tłuszczu. Zmiany te przyczyniają się do znacznego zmniejszenia powstawania zapalnych, miażdżycowych, obciążonych cholesterolem płytek obserwowanych w początkowym stadium miażdżycy.
Nowotwór. Przyjmowanie bakterii probiotycznych może zredukować ryzyko powstawania nowotworów, w szczególności okrężnicy. Naukowcy wykazali, że suplementacja Lactobacillus acidophilus i Bifidobacterium longum, znacznie zmniejsza uszkodzenia DNA, które mogą powodować rozwój komórek złośliwych – co potwierdza redukcja związków przerywających nici DNA w ludzkim kale. Uzupełnianie korzystnych bakterii za pomocą suplementacji zwiększa naturalne, antyoksydacyjne i detoksykacyjne enzymy, które zapobiegają aktywacji potencjalnych substancji nowotworotwórczych pochodzących z diety.
Ponadto, jak wykazano wśród pacjentów cierpiących na nowotwór jelita grubego oraz osób z przednowotworowymi polipami, suplementacja synbiotyków (bakterii probiotycznych w połączeniu z prebiotykami , substancjami, które je promują i odżywiają), spowodowała znaczną redukcję proliferacji nieprawidłowych komórek jelita grubego i zmniejszenie poziomu szkodliwych bakterii Clostridium.
Infekcje dróg oddechowych. Probiotyki mogą znacznie zahamować wiele rodzajów infekcji dróg oddechowych, takich jak powszechne przeziębienia czy grypa, zwłaszcza jeśli suplementację rozpocznie się przed sezonem zachorowań. Według badań, 3-6 miesięczna suplementacja różnych szczepów bifidobakterii i Lactobacillus zmniejsza czas trwania objawów średnio od jednego do dwóch lub nawet kilku dni, podobnie jak w przypadku redukcji nasilenia objawów. Podczas dwóch prób przeprowadzonych na dzieciach, które otrzymywały zarówno Lactobacillus i Bifidobacterium dwa razy dziennie przez okres od 3 do 6 miesięcy, stwierdzono znaczny spadek nieobecności w szkole i konieczności przyjmowania antybiotyków, podobnie jak w przypadku redukcji i czasu trwania objawów choroby.
Regularne stosowanie probiotyków, zmniejsza o 19% kolonizację potencjalnie patogennych bakterii w nosie, będących powszechnym powikłaniem przeziębienia, podczas gdy w grupie kontrolnej nie wykazano żadnych zmian. Efekt ten może uratować życie osobom starszym, jak i pacjentom cierpiącym na osłabiony układ odpornościowy z powodu przewlekłych chorób, jak np. cukrzyca, czy przebycia poważnej operacji, ponieważ są one w grupie zwiększonego ryzyka śmierci w wyniku infekcji bakteryjnej, szczególnie zapalenia płuc.
Antybiotyki. Jedną z przyczyn zaburzenia równowagi pomiędzy dobrymi a złymi bakteriami jest niepotrzebne stosowanie antybiotyków. Nawet niewielkie ilości, poniżej dawki terapeutycznej, mogą zakłócić liczbę i relatywne proporcje bakterii jelitowych. Preparaty dla niemowląt. Powszechne ich stosowanie, zamiast karmienia mlekiem matki, zrywa z długą historią przekazywania bakterii z kobiety na dziecko. Podobnie, poród cesarskim cięciem zapobiega dziedziczeniu przez noworodka różnych bakterii.
Nadmierna higiena. Obsesja na tle higieny drastycznie redukuje zdolność do naturalnego nabywania pewnych kluczowych bakterii z naszego środowiska.
Zachodnia dieta, która jest pełna białka zwierzęcego oraz tłuszczów, cukru i rafinowanych węglowodanów powoduje wzrost niepożądanych bakterii. Przykładem może być wzrost bakterii Firmicutes związanych z otyłością. Na wiele posiłków diety zachodniej składają się rafinowane węglowodany, które są wchłaniane w górnej części przewodu pokarmowego. Ostatecznie, do jelita grubego dociera mikroflora o ograniczonej wartości, gdyż zawiera jedynie niewielką ilości minerałów, witamin i innych składników pokarmowych niezbędnych do jej utrzymania. W efekcie, liczba i różnorodność korzystnych bakterii jelitowych jest znacznie ograniczona, w porównaniu z dietą ludzi żyjących w czasach paleolitu.
Jak zaobserwowano, w porównaniu z osobami zdrowymi, u pacjentów w stanie krytycznym, często wykazuje się 10000 razy mniej m.in. bakterii Bifidobacterium i Lactobacillus. Ujawnia się u nich również 100 razy więcej patogenicznych (chorobotwórczych) bakterii, takich jak Staphylococcus. Co więcej, wśród osób ze znacznie ograniczoną populacją i różnorodnością mikroflory w połączeniu z obecnością dużych ilości enterokoków, niewydolność narządów czy śmiertelność na oddziałach intensywnej opieki jest bardziej powszechna.
Zaburzenia równowagi flory jelitowej, jak udowodniono, upośledza zdolność organizmu do utrzymania integralności śluzówki błon, warstw ochronnych, które zapobiegają wniknięciu patogenów do narządów i jamy ciała.
Post wydał Ci się wartościowy?a może po prostu mnie lubisz ;)?podziel się nim na Facebooku i go udostępnij!
Polub tego bloga na FB https://www.facebook.com/zdrowiebeztajemnic
(Pelto et al., 1998). L. johnsonii La1 was shown to increase the respiratory burst of hagocytes isolated from human blood following probiotic consumption
Hakansson A, Molin G. Gut microbiota and inflammation. Nutrients. 2011 June; 3(6):637-82.
Ejtahed HS, Mohtadi-Nia J, Homayouni-Rad A, Niafar M, Asghari-Jafarabadi M, Mofid V. Probiotic yogurt improves antioxidant status in type 2 diabetic patients. Nutrition. 2012 May;28(5):539-43.
Oberreuther-Moschner DL, Jahreis G, Rechkemmer G, Pool-Zobel BL. Dietary intervention with the probiotics Lactobacillus acidophilus 145 and Bifidobacterium longum 913 modulates the potential of human faecal water to induce damage in HT29clone19A cells. Br J Nutr. 2004 Jun;91(6):925-32.
Kumar M, Kumar A, Nagpal R, et al. Cancer-preventing attributes of probiotics: an update. Int J Food Sci Nutr. 2010 Aug;61(5):473-96.
de Moreno de LeBlanc A, Matar C, Perdigon G. The application of probiotics in cancer. Br J Nutr.2007 Oct;98 Suppl 1:S105-10.
Kumar M, Kumar A, Nagpal R, et al. Cancer-preventing attributes of probiotics: an update. Int J Food Sci Nutr. 2010 Aug;61(5):473-96.
de Moreno de LeBlanc A, Matar C, Perdigon G. The application of probiotics in cancer. Br J Nutr.2007 Oct;98 Suppl 1:S105-10.
Soltan Dallal MM, Yazdi MH, Holakuyee M, Hassan ZM, Abolhassani M, Mahdavi M. Lactobacillus casei ssp.casei induced Th1 cytokine profile and natural killer cells activity in invasive ductal carcinoma bearing mice. Iran J Allergy Asthma Immunol. 2012 Jun;11(2):183-9.
de Moreno de LeBlanc A, Matar C, Perdigon G. The application of probiotics in cancer. Br J Nutr.2007 Oct;98 Suppl 1:S105-10.
Magrone T, Jirillo E. The interplay between the gut immune system and microbiota in health and disease: nutraceutical intervention for restoring intestinal homeostasis. Curr Pharm Des. 2013;19(7):1329-42.
Sivieri K, Villarreal ML, Adorno MA, Sakamoto IK, Saad SM, Rossi EA. Lactobacillus acidophilus CRL 1014 improved “gut health” in the SHIME(R) reactor. BMC Gastroenterol. 2013 Jun 11;13(1):100.
Kaur IP, Kuhad A, Garg A, Chopra K. Probiotics: delineation of prophylactic and therapeutic benefits. J Med Food. 2009 Apr;12(2):219-35.
Ouwehand AC, Tiihonen K, Saarinen M, Putaala H, Rautonen N. Influence of a combination ofLactobacillus acidophilus NCFM and lactitol on healthy elderly: intestinal and immune parameters. Br J Nutr. 2009 Feb;101(3):367-75.
Buzas GM. Probiotics in gastroenterology — from a different angle. Orv Hetil. 2013 Feb 24;154(8):294-304.
Kondo J, Xiao JZ, Shirahata A, et al. Modulatory effects of Bifidobacterium longum BB536 on defecation in elderly patients receiving enteral feeding. World J Gastroenterol. 2013 Apr 14;19(14):2162-70.
Buzas GM. Probiotics in gastroenterology — from a different angle. Orv Hetil. 2013 Feb 24;154(8):294-304.
Guyonnet D, Schlumberger A, Mhamdi L, Jakob S, Chassany O. Fermented milk containingBifidobacterium lactis DN-173 010 improves gastrointestinal well-being and digestive symptoms in women reporting minor digestive symptoms: a randomised, double-blind, parallel, controlled study. Br J Nutr. 2009 Dec;102(11):1654-62.
Ringel-Kulka T, Palsson OS, Maier D, et al. Probiotic bacteria Lactobacillus acidophilus NCFM andBifidobacterium lactis Bi-07 versus placebo for the symptoms of bloating in patients with functional bowel disorders: a double-blind study. J Clin Gastroenterol. 2011 Jul;45(6):518-25.
Bixquert Jiménez M. Treatment of irritable bowel syndrome with probiotics. An etiopathogenic approach at last? Rev Esp Enferm Dig. 2009 Aug;101(8):553-64.
Ejtahed HS, Mohtadi-Nia J, Homayouni-Rad A, Niafar M, Asghari-Jafarabadi M, Mofid V. Probiotic yogurt improves antioxidant status in type 2 diabetic patients. Nutrition. 2012 May;28(5):539-43.
Kadooka Y, Sato M, Imaizumi K, et al. Regulation of abdominal adiposity by probiotics (Lactobacillus gasseri SBT2055) in adults with obese tendencies in a randomized controlled trial.Eur J Clin Nutr. 2010 Jun;64(6):636-43.
Park DY, Ahn YT, Park SH, et al. Supplementation of Lactobacillus curvatus HY7601 andLactobacillus plantarum KY1032 in diet-induced obese mice is associated with gut microbial changes and reduction in obesity. PLoS One. 2013;8(3):e59470.
Yoo SR, Kim YJ, Park DY, et al. Probiotics L. plantarum and L. curvatus in combination alter hepatic lipid metabolism and suppress diet-induced obesity. Obesity (Silver Spring). 2013 Mar 20.
Luoto R, Kalliomaki M, Laitinen K, Isolauri E. The impact of perinatal probiotic intervention on the development of overweight and obesity: follow-up study from birth to 10 years. Int J Obes(Lond). 2010 Oct;34(10):1531-7.
Ilmonen J, Isolauri E, Poussa T, Laitinen K. Impact of dietary counselling and probiotic intervention on maternal anthropometric measurements during and after pregnancy: a randomized placebo-controlled trial. Clin Nutr. 2011 Apr;30(2):156-64.
Moroti C, Souza Magri LF, de Rezende Costa M, Cavallini DC, Sivieri K. Effect of the consumption of a new symbiotic shake on glycemia and cholesterol levels in elderly people with type 2 diabetes mellitus. Lipids Health Dis. 2012;11:29.
Tomaro-Duchesneau C, Saha S, Malhotra M, et al. Effect of orally administered L. fermentum NCIMB 5221 on markers of metabolic syndrome: an in vivo analysis using ZDF rats. Appl Microbiol Biotechnol. 2013 Oct 13.
Ejtahed HS, Mohtadi-Nia J, Homayouni-Rad A, et al. Effect of probiotic yogurt containingLactobacillus acidophilus and Bifidobacterium lactis on lipid profile in individuals with type 2 diabetes mellitus. J Dairy Sci. 2011 Jul;94(7):3288-94.
Kumar M, Nagpal R, Kumar R, et al. Cholesterol-lowering probiotics as potential biotherapeutics for metabolic diseases. Exp Diabetes Res. 2012;2012:902917.
Mencarelli A, Cipriani S, Renga B, et al. VSL#3 resets insulin signaling and protects against NASH and atherosclerosis in a model of genetic dyslipidemia and intestinal inflammation. PLoS One.2012;7(9):e45425.
Yoon HS, Ju JH, Kim HN, et al. Reduction in cholesterol absorption in Caco-2 cells through the down-regulation of Niemann-Pick C1-like 1 by the putative probiotic strains Lactobacillus rhamnosus BFE5264 and Lactobacillus plantarum NR74 from fermented foods. Int J Food Sci Nutr.2013 Feb;64(1):44-52.
Mencarelli A, Cipriani S, Renga B, et al. VSL#3 resets insulin signaling and protects against NASH and atherosclerosis in a model of genetic dyslipidemia and intestinal inflammation. PLoS One.2012;7(9):e45425.
Mohania D, Kansal VK, Shah D, et al. Therapeutic effect of probiotic dahi on plasma, aortic, and hepatic lipid profile of hypercholesterolemic rats. J Cardiovasc Pharmacol Ther. 2013 May 12.
Cavallini DC, Suzuki JY, Abdalla DS, et al. Influence of a probiotic soy product on fecal microbiota and its association with cardiovascular risk factors in an animal model. Lipids Health Dis.2011;10:126.
Stein K, Borowicki A, Scharlau D, et al. Effects of synbiotic fermentation products on primary chemoprevention in human colon cells. J Nutr Biochem. 2012 Jul;23(7):777-84.
Oberreuther-Moschner DL, Jahreis G, Rechkemmer G, Pool-Zobel BL. Dietary intervention with the probiotics Lactobacillus acidophilus 145 and Bifidobacterium longum 913 modulates the potential of human faecal water to induce damage in HT29clone19A cells. Br J Nutr. 2004 Jun;91(6):925-32.
Stein K, Borowicki A, Scharlau D, et al. Effects of synbiotic fermentation products on primary chemoprevention in human colon cells. J Nutr Biochem. 2012 Jul;23(7):777-84.
Verma A, Shukla G. Probiotics Lactobacillus rhamnosus GG, Lactobacillus acidophilus suppresses DMH-induced procarcinogenic fecal enzymes and preneoplastic aberrant crypt foci in early colon carcinogenesis in Sprague Dawley rats. Nutr Cancer. 2013;65(1):84-91.
Rafter J, Bennett M, Caderni G, et al. Dietary synbiotics reduce cancer risk factors in polypectomized and colon cancer patients. Am J Clin Nutr. 2007 Feb;85(2):488-96.
Leyer GJ, Li S, Mubasher ME, Reifer C, Ouwehand AC. Probiotic effects on cold and influenza-like symptom incidence and duration in children. Pediatrics. 2009 Aug;124(2):e172-9.
Rerksuppaphol S, Rerksuppaphol L. Randomized controlled trial of probiotics to reduce common cold in schoolchildren. Pediatr Int. 2012 Oct;54(5):682-7.
Gluck U, Gebbers JO. Ingested probiotics reduce nasal colonization with pathogenic bacteria (Staphylococcus aureus, Streptococcus pneumoniae, and beta-hemolytic streptococci). Am J Clin Nutr. 2003 Feb;77(2):517-20.
Hamilton EJ, Martin N, Makepeace A, Sillars BA, Davis WA, Davis TM. Incidence and predictors of hospitalization for bacterial infection in community-based patients with type 2 diabetes: the fremantle diabetes study. PLoS One. 2013;8(3):e60502.
Weiskopf D, Weinberger B, Grubeck-Loebenstein B. The aging of the immune system. Transpl Int. 2009 Nov;22(11):1041-50.
Available at: lung.org/lung-disease/pneumonia/understanding-pneumonia.html. Accessed October 17, 2013.
Million M, Lagier JC, Yahav D, Paul M. Gut bacterial microbiota and obesity. Clin Microbiol Infect.2013 Apr;19(4):305-13.
Van den Abbeele P, Verstraete W, El Aidy S, Geirnaert A, Van de Wiele T. Prebiotics, faecal transplants and microbial network units to stimulate biodiversity of the human gut microbiome. Microb Biotechnol. 2013 Jul;6(4):335-40.
Turnbaugh PJ, Ridaura VK, Faith JJ, Rey FE, Knight R, Gordon JI. The effect of diet on the human gut microbiome: a metagenomic analysis in humanized gnotobiotic mice. Sci Transl Med. 2009 Nov 11;1(6):6ra14.
Million M, Lagier JC, Yahav D, Paul M. Gut bacterial microbiota and obesity. Clin Microbiol Infect.2013 Apr;19(4):305-13.
Bengmark S. Nutrition of the critically ill—A 21st-century perspective. Nutrients. 2013 January; 5(1):162-207.
Iapichino G, Callegari ML, Marzorati S, Cigada M, Corbella D, Ferrari S, Morelli L. Impact of antibiotics on the gut microbiota of critically ill patients. J Med Microbiol. 2008;57:1007-14.
Bengmark S. Nutrition of the critically ill—A 21st-century perspective. Nutrients. 2013 January; 5(1):162-207.
British Journal of Nutrition (2011)Michae ¨l Messaoudi1*, Robert Lalonde2, Nicolas Violle1, Herve ´ Javelot3, Didier Desor4, Amine Nejdi1, Jean-Franc ¸ois Bisson1, Catherine Rougeot5, Matthieu Pichelin6, Murielle Cazaubiel6 and Jean-Marc Cazaubiel6: “Assessment of psychotropic-like properties of a probiotic formulation (Lactobacillus helveticus R0052 and Bifidobacterium longum R0175) in rats and human subjects”
onlinelibrary.wiley.com/doi/10.1111/j.1365-2982.2011.01796.x/abstract?deniedAccessCustomisedMessage=&userIsAuthenticated=false
(Korzenik and Podolsky, 2006; Strober et al., 2002 )
horizonpress.com/cimb/v/v10/37.pdf
ncbi.nlm.nih.gov/pmc/articles/PMC4449865/
europepmc.org/abstract/MED/12776000/reload=0;jsessionid=gaKDYzQTJeMIFlasebaS.4
journals.lww.com/jcge/Abstract/2005/05003/Nerves,_Reflexes,_and_the_Enteric_Nervous_System_.2.aspx
ncbi.nlm.nih.gov/pubmed/7743145
ncbi.nlm.nih.gov/pubmed/15765388
ncbi.nlm.nih.gov/pubmed/22136422
ncbi.nlm.nih.gov/pubmed/21988661
onlinelibrary.wiley.com/doi/10.1002/1097-0185%2820010101%29262:1%3C79::AID-AR1013%3E3.0.CO;2-K/full
journals.lww.com/co-gastroenterology/Abstract/1999/07000/Pathogenesis_of_inflammatory_bowel_disease.3.aspx
ncbi.nlm.nih.gov/pubmed/19235895
sciencedirect.com/science/article/pii/S0165032712001371
plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0001308
sciencedirect.com/science/article/pii/S0091674904020810
nature.com/ajg/journal/v101/n7/abs/ajg2006294a.html
ncbi.nlm.nih.gov/pubmed/15765388
ncbi.nlm.nih.gov/pubmed/12117257
ncbi.nlm.nih.gov/pubmed/22811591
ncbi.nlm.nih.gov/pubmed/19703242
ncbi.nlm.nih.gov/pubmed/17395175
ncbi.nlm.nih.gov/pubmed/25517879
ncbi.nlm.nih.gov/pubmed/21365446
ncbi.nlm.nih.gov/pubmed/24257436
ncbi.nlm.nih.gov/pubmed/24735374
ncbi.nlm.nih.gov/pubmed/22548208
ncbi.nlm.nih.gov/pubmed/17359385
ncbi.nlm.nih.gov/pubmed/25518825
ncbi.nlm.nih.gov/pubmed/24987799
ncbi.nlm.nih.gov/pubmed/23618528
ncbi.nlm.nih.gov/pubmed/22093263
ncbi.nlm.nih.gov/pubmed/24475018
ncbi.nlm.nih.gov/pubmed/25331262
ncbi.nlm.nih.gov/pubmed/24556493
ncbi.nlm.nih.gov/pubmed/20659698
ncbi.nlm.nih.gov/pubmed/25178882
ncbi.nlm.nih.gov/pubmed/18727656
ncbi.nlm.nih.gov/pubmed/19453574
ncbi.nlm.nih.gov/pubmed/9820379
ncbi.nlm.nih.gov/pubmed/18263567
ncbi.nlm.nih.gov/pubmed/19528183
ncbi.nlm.nih.gov/pubmed/22610429
ncbi.nlm.nih.gov/pubmed/23122647
ncbi.nlm.nih.gov/pubmed/25291127
ncbi.nlm.nih.gov/pubmed/22230409
ncbi.nlm.nih.gov/pubmed/25291124
ncbi.nlm.nih.gov/pubmed/21895621
Dugas B, Mecenier A, Lenoir-Wijnkoop I i wsp. Immunity and probiotics. Immunology Today 1999, 20: 387-389.
Isolauri E, Sutas Y, Kankaanpaa P i wsp. Probiotics: Effect on immunity. Clinical Nutrition 2001, 73: 444-449.
Nagler-Anderson C. Man the barrier! Strategic defences in the intestinal mucosa. Nature Reviews/Immunology 2001, 1: 59-67.
Brantzaeg P. Current understanding of gastrointestinal immunoregulation and its relation to food allergy. Ann. N.Y. Acad. Sci. 2002, 964: 13-4.
Kopp-Hoolihan L. Prophylactic and therapeutic uses of probiotics: a review. Diet Assoc. 2001, 101: 229-238.
Gill HS, Rutherfurd K J, Prasad J, Gopal PK. Enhancement of natural and acquired immunity by Lactobacillus rhamnosus (HN001), Lactobacillus acidophilus (HN017) and Bifidobacterium lactis (HN019). Br.J.Nut. 2000, 83: 167-176.
Arunachalam K, Gill HS, Chandra RK. Enhancement of immune function by dietary consumption of Bifidobacterium lactis (HN019). Eur. J. Clin. Nutr. 2000, 54: 263-267.
Chiang BL, Sheich YH, Wang LH i wsp. Enhancing immunity by dietary consumption of a probiotic lactic acid bacterium (Bifidobacterium lactis HN019): optimization and definition of cellular immune responses. Eur.J.Clin.Nutr. 2000, 54: 848-855.
Gill HS, Rutherfurd K, Cross ML, Gopal PK. Enhancement of immunity in the elderly by dietary supplementation with the probiotic Bifidobacterium lactis HN019. Am.J.Nutr.2001, 74: 833-839.
Gill HS, Rutherfurd K. Immune enhancement conferred by oral delivery of Lactobacillus Rhamnosus HN001 in different milk-based substrates. J.Dairy.Res. 2001, 68: 611-616.
Miettinen M, Matakainen S, Vuopio-Varkila J i wsp. Lactobacilli and streptococci induce interleukin-12 (IL-12), IL-18 and gamma interferon production in human peripheral blood mononuclear cells. Infection Immunity, 1998, 66:6058-6062.
Miettinen M, Vuopio-Varkila J, Varkila K. Production of human tumour necrosis factor alfa, interleukin-6, and IL-10 is induced by lactic acid bacteria. Infection Immunity 1996, 64: 5403-5405.
Haller D, Blum S, Bode C i wsp. Activation of human peripheral blood mononuclear cells by non-pathogenic bacteria in vitro: evidence of NK cells as primary targets. Infection Immunity 2000, 68: 752-759.
Michałkiewicz J, Krotkiewski M, Gackowska L i wsp. Target cell for immunomodulating effect of lactic acid bacteria. Microb. Ecol. Health. Dis. 2003, in press.
Michałkiewicz J, Krotkiewski M, Gackowska L i wsp. Interaction and synergism of lactic acid bacteria necessary for the balance between the proinflammatory and immunological defence enhancing effects of probiotics. Microb. Ecol. Health. Dis. 2003, submitted.
Maasen CMB, van Holten-Neelen C, Balk F i wsp. Strain-dependent induction of cytokine profiles in the gut by orally administered Lactobacillus strains. Vaccine, 2000, 18: 2613-2623.
Strobel S, Mowat A. Immune responses to dietary antigens: oral tolerance. Immunology Today 1998, 19: 173-180.
Wold AE. Immune effects of probiotics. Scand.J.Nutr. 2001, 45: 76-85.
Bradtzaeg P, Baekkevold ES, Farstad IN i wsp. Regional specialization in the mucosal immune system: what happens In the microcompartments? Immunology Today 1999, 20: 141-151.
Health and nutritional properties of probiotics in food including milk with live lactic acid bacteria,
Raport of a Joint FAO/WHO Expert Consultation. Cordoba, Argentina, 2001.
Shi Y, Chen L, Tong J, Xu C. Preliminary characterization of vaginal microbiota in healthy Chinese
women using cultivation-independent methods. J Obstet Gynaecol Res. 2009;35(3):525-32.
Vásquez A, Jakobsson T, Ahrné S, Forsum U, Molin G. Vaginal lactobacillus flora of healthy Swedish
women. J Clin Microbiol. 2002;40(8):2746-9.
Zhou X, Brown CJ, Abdo Z, Davis CC, Hansmann MA, Joyce P, Foster JA, Forney LJ. Differences
in the composition of vaginal microbial communities found in healthy Caucasian and black women.
ISME J. 2007;1(2):121-33.
Zhou X, Hansmann MA, Davis CC, Suzuki H, Brown CJ, Schütte U, Pierson JD, Forney LJ. The
vaginal bacterial communities of Japanese women resemble those of women in other racial groups.
FEMS Immunol Med Microbiol. 2010; 58(2):169-81.
Garg KB, Ganguli I, Das R, Talwar GP. Spectrum of Lactobacillus species present in healthy vagina
of Indian women. Indian J Med Res. 2009; 129(6):652-7.
Strus M, Brzychczy-Włoch M, Kucharska A, Gosiewski T, Heczko PB. Działanie in vitro bakterii
z rodzaju Lactobacillus izolowanych z pochwy na grzyby wywołujące kandydozę sromu i pochwy.
Med Dooew Mikrobiol. 2005; 55: 7-17.
Heczko P. Sprawozdanie z badań laboratoryjnych właściwości probiotycznych szczepów probiotycznych
bakterii z rodzaju Lactobacillus wykonanych w Katedrze Mikrobiologii Collegium Medicum
UJ. 2004
Strus M. Sprawozdanie z badań dotyczących zjawiska adherencji wybranych szczepów do ludzkich
linii tkankowych HT-29 MTX i Caco-2. 2010
Strus M, Kochan P, Chełmicki Z, Chełmicki A, Stefański G, Dechnik K, Jabłońska E, Heczko P.
Wpływ doustnego podawania trzech probiotycznych szczepów Lactobacillus na poprawę odczynu
i składu mikroflory pochwy u kobiet w wieku reprodukcyjnym. Gin. Dypl. 2008; 3: 53-59.
Heczko P. Sprawozdanie z badań laboratoryjnych nad właściwościami probiotycznymi szczepów
bakterii z rodzaju Lactobacillus w preparacie prOVag firmy IBSS BIOMED S.A. w Krakowie. 2006
Heczko P. Ocena skuteczności kolonizacji dróg rodnych i odbytu w trakcie stosowania preparatu
pro biotycznego prOVag. 2007
Osset J, Bartolomé RM, García E, Andreu A. Assessment of the capacity of Lactobacillus to
inhibit the growth of uropathogens and block their adhesion to vaginal epithelial cells. J Infect Dis.
2001;183(3):485-91.
Strus M. Sprawozdanie z badań dotyczących zdolności do hamowania adhezji patogenów do
powierzchni komórek nabłonka pochwy przez szczepy probiotyczne: Lactobacillus fermentum 57A,
Lactobacillus plantarum 57B, Lactobacillus gasseri 57C oraz ich mieszaninę. 2010
Ocana VS, de Ruiz Holgado AA, Nader-Macías ME. Growth inhibition of Staphylococcus aureus
by H2O2-producing Lactobacillus paracasei subsp. paracasei isolated from the human vagina.
FEMS Immunol Med Microbiol. 1999;23(2):87-92
Strus M, Brzychczy-Włoch M, Kochan P, Heczko P. Nadtlenek wodoru w regulacji mikroflory
pochwy. Med Dosw Mikrobiol. 2004;56(1):67-77.
Strus M. Sprawozdanie z badania zdolności produkcji przez szczepy probiotyczne enzymów
antyoksydacyjnych o charakterze przeciwzapalnym. 2010.
Guidelines for the Evaluation of Probiotics in Food. Report of a joint FAO/WHO Working Group
on Drafting Guidelines for the Evaluation of Probiotics in Food. 2002
Strus M. Badanie hamującego działania nonoksynolu-9 na wybrane szczepy Lactobacillus fermentum
57A, Lactobacillus plantarum 57B i Lactobacillus gasseri 57C w czasie 5 i 24 godzin. 2008
Strus M. Sprawozdanie z badań nad opornością bakterii probiotycznych na leki przeciwdrobnoustrojowe.
2010.
(Haller et al., 2000).
(Schiffrin et al., 1997)(Arunachalam et al., 2000)
(Pelto et al., 1998)
(Gill et al., 2001a; Sheih et al., 2001)
(Ogawa et al., 2006)
(Takeda et al., 2006)
(Donnet-Hughes et al., 1999)
(Lammers et al., 2002; Otte and Podolsky, 2004)
(Zhang et al., 2005)
(Ma et al., 2004)
(Ruiz et al., 2005)
(Vinderola et al., 2005)
(Ogawa et al., 2006)
(Isolauri et al., 1995)
(Pochard et al., 2002)
(Shida et al., 2002)
(Pohjavuori et al., 2004)
(Sutas et al., 1996a)
(Arunachalam et al., 2000; Kishi et al., 1996)
(Miettinen et al., 1998)
(Perdigon et al., 2002)
(Pessi et al., 2000)
(Kuhn et al., 1993)
(Madsen et al., 1999)
(Sheil et al., 2004)
(Pena et al., 2005)
https://pl.wikipedia.org/wiki/Immunoglobuliny_A
Kwas masłowy i HMB – na ratunek w nieszczelności jelit, ch.Crohna, Mukowiscydozy – i z 10 innych zastosowań…
 Kwas masłowy należy do kwasów krótko – łańcuchowych wytwarzanych przez bakterie jelitowe w procesie fermentacji oraz zawarty jest w takich produktach diety jak sery,kapusta kiszona, ogórki kiszone, fermentowana soja jednak w małych ilościach. Z kolei oporna skrobia, owies i otręby pszenne zawierają spore jego ilości gdyż skrobia z dużą zawartością amylozy dostarcza opornej skrobi bakteriom, które produkują kwas masłowy. Kiedyś doskonale poznałem doświadczając działanie tego kwasu w postaci popularnego suplementu dla sportowców HMB który b.fajnie utwardzał mase ciała zdobytą na treningach na siłowni – jednak nie o jego właściwościach dla sportowców(zwiększanie beztłuszczowej masy ciała oraz redukcja tłuszczu) będzie dzisiaj mowa. Już nie raz spotkałem się w badanich z naprawdę porządanymi w dzisiejszych czasach właściwościami prozdrowotnymi tego kwasu. Kwas masłowy stanowi materiał energetyczny dla prawidłowych komórek nabłonka jelitowego,wzmacnia utrzymanie prawidłowej błony jelitowej oraz wywiera pośredni wpływ na inne narządy i tkanki poza przewodem pokarmowych. Zmniejsza on nasilone objawy biegunkowe(jeden z możliwych efektów ubocznych stosowania antybiotykoterapi) poprzez regulację wchłaniania w jelitach oraz przywraca prawidłową motorykę przewodu pokarmowego. Poprzez zwiększanie przyswajania sodu i wody w jelicie cienkim(napewno spotkaliście się gdzieś z zaleceniami picia wody mineralnej z solą himalajską w celu odbudowania błony śluzowej żołądka i jelit?zastosowanie dodatkowo HMB maksymalnie zwiększy ten efekt!) przyspiesza regenerację zniszczonych komórek nabłonka jelitowego. Wykazuje także działanie przeciw alergiczne, przeciwzapalne i chroni przed przedostaniem się bakteri z jelit do krwiobiegu(bardzo ważne przy Candidzie, antybiotykoterapi, Autyzmie, Boreliozie i innych problemach gdzie dobra kondycja jelit to podstawa do wyleczenia).
Kwas masłowy należy do kwasów krótko – łańcuchowych wytwarzanych przez bakterie jelitowe w procesie fermentacji oraz zawarty jest w takich produktach diety jak sery,kapusta kiszona, ogórki kiszone, fermentowana soja jednak w małych ilościach. Z kolei oporna skrobia, owies i otręby pszenne zawierają spore jego ilości gdyż skrobia z dużą zawartością amylozy dostarcza opornej skrobi bakteriom, które produkują kwas masłowy. Kiedyś doskonale poznałem doświadczając działanie tego kwasu w postaci popularnego suplementu dla sportowców HMB który b.fajnie utwardzał mase ciała zdobytą na treningach na siłowni – jednak nie o jego właściwościach dla sportowców(zwiększanie beztłuszczowej masy ciała oraz redukcja tłuszczu) będzie dzisiaj mowa. Już nie raz spotkałem się w badanich z naprawdę porządanymi w dzisiejszych czasach właściwościami prozdrowotnymi tego kwasu. Kwas masłowy stanowi materiał energetyczny dla prawidłowych komórek nabłonka jelitowego,wzmacnia utrzymanie prawidłowej błony jelitowej oraz wywiera pośredni wpływ na inne narządy i tkanki poza przewodem pokarmowych. Zmniejsza on nasilone objawy biegunkowe(jeden z możliwych efektów ubocznych stosowania antybiotykoterapi) poprzez regulację wchłaniania w jelitach oraz przywraca prawidłową motorykę przewodu pokarmowego. Poprzez zwiększanie przyswajania sodu i wody w jelicie cienkim(napewno spotkaliście się gdzieś z zaleceniami picia wody mineralnej z solą himalajską w celu odbudowania błony śluzowej żołądka i jelit?zastosowanie dodatkowo HMB maksymalnie zwiększy ten efekt!) przyspiesza regenerację zniszczonych komórek nabłonka jelitowego. Wykazuje także działanie przeciw alergiczne, przeciwzapalne i chroni przed przedostaniem się bakteri z jelit do krwiobiegu(bardzo ważne przy Candidzie, antybiotykoterapi, Autyzmie, Boreliozie i innych problemach gdzie dobra kondycja jelit to podstawa do wyleczenia).
Naturalnie niedobór kwasu masłowego w przewodzie pokarmowym powoduje odwrotny skutek tzn. zaburzenia funkcjonowania błony śluzowej jelita cienkiego jak i grubego – brak ich szczelności oraz niedobory energetyczne w kolonocytach. W badaniach wykazano, iż suplementacja tym kwasem jest bardzo wskazana w takich chorobach jak wrzodzejące zapalenie jelita grubego, choroba Leśniowskiego-Crohna, IBS(Zespół jelita drażliwego) i inne zapalenia jelit(np. po chemioterapi). Wykazuje również działanie przeciwzapalne powodując obniżenie poziomu cytokin zapalnych takich jak TNF alfa, IL-6, IL-8 czy też czynnik transkrypcyjny NF-kappaB przez blokowanie deacetylazy histonów(HDAC) co powoduje również zmniejszenie insulinooporności oraz zmniejsza potencjalne ryzyko chorób kardiologicznych.. . Wzbogacanie diety w kwas masłowy jest wskazane na wszystkich etapach choroby uchyłkowej: od profilaktyki zalecanej w uchyłkowatości, poprzez objawową chorobę uchyłkową (bóle w lewym dole biodrowym, zmiana rytmu wypróżnień, wzdęcia), aż po wspomaganie leczenia powikłanej choroby uchyłkowej, potwierdzonej badaniami endoskopowymi, biochemicznymi czy obrazowymi. Dane z literatury badawczo-medycznej podkreślają pozytywny wpływ maślanu sodu na komórki nowotworowe jelita grubego polegający na nasileniu ich apoptozy(śmierci) jak i stopuje tworzenie się nowych naczyń krwionośnych odżywiających guza(potwierdzone badaniami in vivo i in vitro) oraz posiada właściwości antymetastatyczne(blokuje przerzuty). Dzieje się to dlatego iż kwas masłowy jest blokerem HDAC(wspominałem troche o nim w artykule o Opioidach). Z kolei zwiększenie aktywności enzymu detoksykującego glutationo-S-transferazy(GST) przez kwas masłowy osłania organizm przed kancerogennym działaniem G2o2 i 4-hydroksononenalem (HNE).
W hipercholesterolemi badania wykazały że kwas masłowy obniża ekspresję (aktywację/działanie) 9 kluczowych genów mających wpływ na syntezę cholesterolu w jelitach. Dowodzi to iż kwas masłowy może być dobrym specyfikiem w leczeniu syndromu metabolicznego u ludzi.
Kwas masłowy i jego pochodne może być też bardzo przydatny przy leczeniu Mukowiscydozy oddziałując na regulator genu CFTR(o którym pisałem już wcześniej tutaj).
Zaawansowane choroby ogólnoustrojowe, zwłaszcza przebiegające z nasilonym katabolizmem, kacheksję, przede wszystkim nowotworową, czy też inne procesy zaburzające prawidłową odporność organizmu (immunosupresja, przewlekła steroidoterapia, zespoły niedoboru odporności, w tym AIDS). We wszystkich tych przypadkach oprócz troficznego wpływu maślanu istotne jest jego działanie anaboliczne oraz korzystny wpływ na procesy krwiotwórcze.
Większość bowiem egzogennego kwasu masłowego ulega szybkiemu wychwytywaniu i wykorzystaniu przez nabłonek górnej części przewodu pokarmowego, nie docierając do segmentów jelitowych będących najczęstszą lokalizacją zmian zapalnych w przebiegu nieswoistego zapalenia jelit. Stąd też kwasu masłowy można stosować w postaci wlewek doodbytniczych.
W otwartych, nierandomizowanych próbach klinicznych z zastosowaniem wlewek doodbytniczych kwasu masłowego lub mieszaniny SCFA(short chain fatty acids-kwasy tłuszczowe o krótkich łańcuchach) przez okres kilku tygodni wykazano skuteczność tego typu leczenia, ze zmniejszeniem nasilenia wskaźników zapalnych.
Również u chorych, którzy w pierwszej fazie badania otrzymywali placebo i nie odpowiedzieli na leczenie, podanie wlewek z SCFA spowodowało poprawę u 65% badanych.
Jedna z nielicznych prób zastosowania doustnego kwasu masłowego w leczeniu Choroby Leśniowskiego-Crohna była praca Di Sabbatino i wsp. z 2007 r. Spośród 13 chorych z łagodną i umiarkowaną postacią ChL-C, leczonych przez 8 tygodni 4 g kwasu masłowego w tabletkach z otoczką ulegającą rozpuszczeniu w pH > 7, 9 (69%) odpowiedziało na terapię, a u 7 (53%) uzyskano remisję choroby (p < 0,05). Jednocześnie wykazano znamienne statystycznie obniżenie wskaźnika CDAI oraz śluzówkowych poziomów NF-kappaB i interleukiny 1 beta(cytokina wzburzające stany zapalne).
Post wydał Ci się wartościowy?a może po prostu mnie lubisz ;)?podziel się nim na Facebooku i go udostępnij!
Polub tego bloga na FB, gdzie znajdziesz też dodatkowe newsy, których tutaj nie publikuje https://www.facebook.com/zdrowiebeztajemnic
Obserwuj mnie na instagramie www.instagram.com/premyslaw84
ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Abstract&list_uids=19747008
dx.doi.org/10.1186/1868-7083-3-4
ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Abstract&list_uids=17555985
pnas.org/content/101/52/18030
nature.com/onc/journal/v26/n37/full/1210620a.html
ncbi.nlm.nih.gov/pubmed/17555985?dopt=Abstract
ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Abstract&list_uids=19383551
ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Abstract&list_uids=16083918
ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Abstract&list_uids=19366864
ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Abstract&list_uids=18642346
ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Abstract&list_uids=10940786
ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Abstract&list_uids=20626746
clinicalepigeneticsjournal.biomedcentral.com/articles/10.1186/1868-7083-4-4
kfd.pl/hmb-metabolit-leucyny-213401.html/
rozanski.li/322/leucyna-i-izoleucyna-a-hmb/
rozanski.li/2271/hmb-hydroxy-methylbutyrate/
rozanski.li/322/leucyna-i-izoleucyna-a-hmb/
termedia.pl/Kwas-maslowy-w-zapaleniach-jelit,41,15573,1,0.html
Roediger WEW. Role of anaerobic bacteria in the metabolic
welfare of the colonic mucosa in man. Gut 1980; 21: 793-8.
Scheppach W, Bartram P, Richter A, et al. Effect of short-chain
fatty acids on the human colonic mucosa in vitro. J Parenter
Enter Nutr 1992; 16: 43-8.
Andoh A, Bamba T, Sasaki M. Physiological and antiinflamatory
roles of diatery fiber and butyrate in intestinal
functions. J Parent Ent Nutr 1999; 23: 70-3.
Claus R, Günthner D, Letzguß H. Effects of feeding fat-coated
butyrate on mucosal morphology and function in the small
intestine of the pig. J Anim Physiol Anim Nutr 2007; 91: 312-8.
Galfi P, Bokori J. Feeding trial in pigs with a diet containing
sodium n-butyrate. Acta Veterinaria Hungarica 1990; 38: 3-17.
D’Argenio G, Cosenza V, Delle Cave M, et al. Butyrate enemas
in experimental colitis and protection against large bowel
cancer in a rat model. Gastroenterology 1996; 110: 1727-34.
Tedelind S, Westberg F, Kjerrulf M, et al. Anti-inflammatory
properties of the short-chain fatty acids acetate and
propionate: a study with relevance to inflammatory bowel
disease. World J Gastroenterol 2007; 13: 2826-32.
Meier-Ruge WA, Ammann K, Bruder E, et al. Updated results
on intestinal neuronal dysplasia (IND B). Eur J Pediatr Surg
2004; 14: 384-91.
Peng L, He Z, Chen W, et al. Effects of butyrate on intestinal
barrier function in Caco-2 cell monolayer model of intestinal
barrier. Pediatr Res 2007; 61: 37-41.
McIntyre A, Gibson PR, Young GP. Butyrate production from
diatery fiber and protection against large bowel cancer in rat
model. Gut 1993; 34: 386-91.
Leder A, Leder P. Butyric acid, a potent inducer of erythroid
differentiation in cultured erythroleukemic cells. Cell 1975; 5:
319-22.
Weinberg R, Ji X, Sutton M, et al. Butyrate increase the
efficiency of translation of ?-globin mRNA. Blod 2005; 105:
1807-9.
Vidyasagar S., Bermeyer C., Geibel J.: Role of short-chain fatty acids in colonic HCO(3) secretion. Am J Physiol Gastrointest Liver Physiol 2005; 288: G1217-G1226.
Segain J.P., de La Bletiere R.D., Bourreille A. et al.: Butyrate inhibits inflammatory responses through NF-?B inhibition: implications for Crohn’s disease. Gut 2000; 47: 397-403.
21. Di Sabatino A., Morera R., Ciccocioppo R. et al.: Oral butyrate for mildly to moderately active Crohn’s disease. Aliment Pharmacol Ther 2005; 22: 789-794.
22. Breuer R.I., Buto S.K., Christ M.L et al.: Rectal irrigation with short-chain fatty acids for distal ulcerative colitis. Preliminary report. Dig Dis Sci 1991; 36: 185-187.
23. Scheppach W., Sommer H., Kirchner T. et al.: Effect of butyrate enemas on the colonic mucosa in distal ulcerative colitis. Gastroenterology 1992; 103: 51-56.
Breuer R.I., Soergel K.H., Lashner B.A. et al.: Short chain fatty acid rectal irrigation for left-sided ulcerative colitis: a randomized, placebo-controlled trial. Gut 1997; 40: 485-491.
Di Sabbatino A., Morrera R., Ciccocioppo R., Cazzola P., Gotti P., Gotti S., Tinozzi F.P., Tinozzi S., Corazza G.R.: Oral butyrate for mildly to moderately active Crohn’s disease. Aliment Pharmacol Ther 2005; 22: 789-794.